
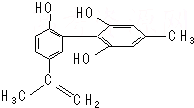
 我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”,坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| C. | 该分子中的所有原子有可能共平面 | |
| D. | 1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
分析 由结构简式可知,分子中含酚-OH、碳碳双键,结合酚、烯烃的性质分析,且苯环、双键为平面结构,而分子中甲基为四面体结构,以此来解答.
解答 解:A.该有机物含有酚羟基,遇FeCl3溶液呈紫色,但含2个苯环、3个酚-OH,与苯酚结构不相似,不是苯酚同系物,故A错误;
B.酚羟基也可以还原高锰酸钾,使酸性高锰酸钾溶液褪色,则滴入KMnO4(H+)溶液,观察紫色褪去,不能证明结构中存在碳碳双键,故B错误;
C.苯环、双键为平面结构,所有碳原子可能共面,而甲基为四面体构型,所有原子不可能共面,故C错误;
D.该物质含两个苯环和一个碳碳双键,1 mol该物质最多可以与7 mol氢气加成,碳碳双键可以与Br2加成,酚羟基的邻位和对位可以与Br2取代,最多消耗4 mol Br2,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚、烯烃性质及原子共面的考查,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑤ | ⑥ | ⑧ | ⑩ | |||
| 3 | ① | ⑦ | ⑨ | |||||
| 4 | ② | ③ |
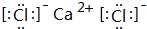 ,化学键类型为离子键(“离子键”或“共价键”).
,化学键类型为离子键(“离子键”或“共价键”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物中酯A的相对分子质量为88 | |
| B. | 18O全部进入水中 | |
| C. | 18O全部进入生成的酯中 | |
| D. | 酯A与H2O水解后在CH3COOH和CH3CH2OH都有18O存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在多电子的原子里,能量高的电子通常在离核远的区域内活动 | |
| B. | 核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层 | |
| C. | 两种微粒,若核外电子排布完全相同,则其化学性质一定相同 | |
| D. | 微粒的最外层只能是8个电子才稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
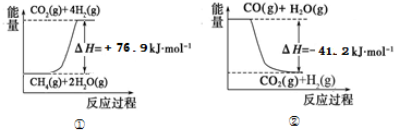
 | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
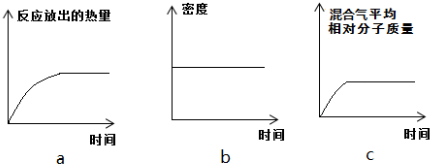
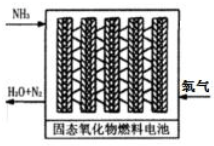
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色 | B. | 苯的邻二氯取代产物只有一种 | ||
| C. | 苯不使溴的四氯化碳溶液褪色 | D. | 苯的对二氯取代产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3
③2-甲基-1-戊烯:CH2=CH(CH3)CH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 0.70×10-10m | C. | 1.20×10-10m | D. | 1.10×10-10m |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com