
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 HBr溶液和20.00 mL0.1000 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示,下列说法不正确的是( )
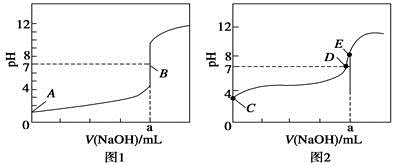
A. 根据图1和图2判断,滴定HBr溶液的曲线是图1
B. a=20.00 mL
C. c(Na+)=c(CH3COO-)的点是B点
D. E点对应溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:广东省2016-2017学年高一上学期期末考试化学试卷 题型:选择题
已知:① 向KMnO4晶体滴加浓盐酸,产生黄绿色气体;② 向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③ 取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝。下列判断正确的是( )。
A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 上述实验中,共有两个氧化还原反应
C. 实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D. 实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省台州市高一上学期期末质量评估考试化学试卷(解析版) 题型:选择题
下列仪器名称为“分液漏斗”的是
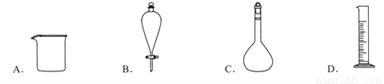
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:填空题
(1)若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为_________________。
(2)分子式为C9H20的某烃其一氯代物只有两种产物,写出符合要求的结构简式________________。
(3)分子式为C5H10的烯烃中不存在顺反异构的物质有_____种。
(4)已知烯烃、炔烃在臭氧作用下发生以下反应:
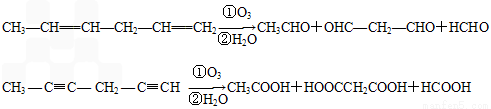
某烃化学式为C10H10,在臭氧作用下发生反应:C10H10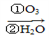 CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
CH3COOH+3HOOC-CHO+CH3CHO ①C10H10分子中含________个双键,________个三键。
②C10H10结构简式为________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) ∆H=-632kJ·mol-1。下图为质子膜H2S燃料电池的示意图。下列说法正确的是( )
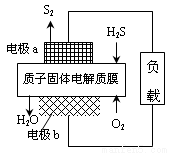
A. 电池工作时,电流从电极a经负载流向电极b
B. 电极a上发生的电极反应为:2H2S - 4e-= S2 + 4H+
C. 当反应生成64gS2时,电池内部释放632kJ热能
D. 当电路中通过4mol电子时,有4mol H+经质子膜进入负极区
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二下学期开学考试化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A. 原电池输出电能的能力,取决于组成原电池的反应物的氧化还原能力
B. 电解质溶液的导电过程,就是电解质溶液的电解过程
C. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D. 电化学腐蚀和化学腐蚀都是金属原子失去电子而被氧化的过程
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:实验题
如图是用自来水制取少量蒸馏水的简易装置(加热及固定仪器略),其原理与教材中的实验完全相同。回答下列问题:

(1)左边大试管中要加入几片碎瓷片,其作用是_________________________________;
(2)该装置中使用的玻璃导管较长,其作用是____________________________________;
(3)烧杯中还要盛有的物质是________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一下学期第一次模块考试化学试卷(解析版) 题型:选择题
①烧杯②坩埚③蒸发皿④试管⑤蒸馏烧瓶⑥锥形瓶⑦燃烧匙
A. ①⑤⑥ B. ③⑥⑦ C. ①⑤ D. ⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三3月高考适应性测试理综化学试卷(解析版) 题型:简答题
消除氮氧化物污染对优化空气质境至关重要。
(1)用CH4催化还原氮氧化物消除氮氧化物的污染发生的反应如下:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO2(g) 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
若用0.2molCH4将NO2还原为N2,则整个过程中放出的热量为________kJ。(假设水全部以气态形式存在)
(2)用活性炭可处理大气污染物NO。在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当沮度分别在T1和T2时.测得反应达到平衡时各物质物质的量如下表;
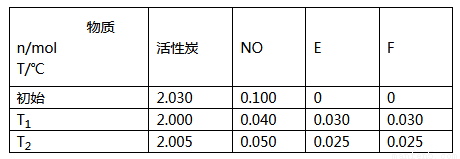
①请结合上表数据.写出NO与活性炭反应的化学方程式_______________。
②T1℃ 时,上述反应的平衡常数的值为________。如果已知T2>T1,则该反应正反应的△H___(填“>”“<”或“=”)0
③ 在T1温度下反应达到平衡后,下列措施不能增大NO转化率的是_______。
a.降低温度 b.增大压强 c.增大c(NO) d.移去部分F
(3)汽车尾气处理中的反应有2NO+2CO 2CO2+N2。某温度时,在1L密闭容器中充入0.1molCO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率v(NO)=________。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正反应方向进行,a的取值范围为_____________。
2CO2+N2。某温度时,在1L密闭容器中充入0.1molCO和0.1mol NO,5s时反应达到平衡,测得NO的浓度为0.02mol/L,则反应开始至平衡时,NO的平均反应速率v(NO)=________。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正反应方向进行,a的取值范围为_____________。
(4)某课题组利用下图所示装置,探究NO2和O2化合生成N2O5形成原电池的过程。物质Y的名称为_______,该电池的正极反应式应为___________。
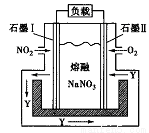
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com