
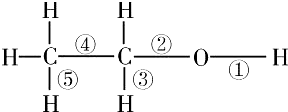
| A、与醋酸、浓硫酸共热时断裂① |
| B、在空气中燃烧时断裂④⑤ |
| C、和金属钠反应时断裂② |
| D、在Cu催化下和O2反应时断裂②③ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鸡蛋白溶液中加入硫酸铵溶液变浑浊 |
| B、用福尔马林溶液浸泡动物标本 |
| C、用波尔多液(含CuSO4等)防治作物病虫害 |
| D、医院用加热法消毒医疗器械 |
查看答案和解析>>
科目:高中化学 来源: 题型:
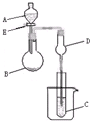 一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:
一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:查看答案和解析>>
科目:高中化学 来源: 题型:
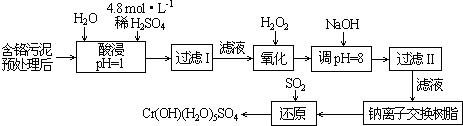
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化镁用作耐火材料 |
| B、向Na2CO3溶液中滴加醋酸溶液,一定有CO2气体生成 |
| C、明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| D、Na2O2常用于潜水艇或呼吸面具的供氧剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.5 mol/L H2SO4 |
| B、0.5 mol/L NaOH |
| C、0.5 mol/L AgNO3 |
| D、0.5 mol/L NH3?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com