
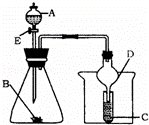
如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述中不正确的是( )
|
| A. | 若A为醋酸,B为贝壳(粉状),C为盛苯酚钠溶液,则C中溶液变浑浊 |
|
| B. | 若A为食盐水,B为电石,C中盛KMnO4溶液,则C中溶液褪色 |
|
| C. | 若A为浓氨水,B为生石灰,C中盛AgNO3溶液,则C中无现象 |
|
| D. | 实验中仪器D可起到防倒吸的作用 |
科目:高中化学 来源: 题型:
原子轨道的杂化不但出现在分子中,原子团中同样存在原子轨道的杂化。在
SO42-中S原子的杂化方式为 ( )。
A.sp B.sp2 C.sp3 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是()
A. CH3Cl不存在同分异构体 B. CH2Cl2不存在同分异构体
C. CHCl3不存在同分异构体 D. CCl4不存在同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关沉淀溶解平衡的说法中,正确的是( )
|
| A. | Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度 |
|
| B. | 在氯化银的沉淀溶解平衡体系中加入蒸馏水,氯化银的Ksp增大 |
|
| C. | 在碳酸钙的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动 |
|
| D. | 向氯化银沉淀溶解平衡体系中加人碘化钾固体,氯化银沉淀可转化为碘化银沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应.
已知:N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ•mol﹣1,
N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=﹣534kJ•mol﹣1.
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: .
(2)已知:N≡N的键能是946kJ•mol﹣1,H﹣H的键能为436kJ•mol﹣1,N﹣H的键能为393kJ•mol﹣1,计算合成氨反应生成1molNH3的△H= kJ•mol﹣1.
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为
②加水稀释100倍,所得溶液中由水电离出c(OH﹣)=
③与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11,该盐酸溶液的pH= .
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO﹣)(填“>”或“=”或“<”).
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO﹣).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
依据元素周期表及元素周期律,下列推断正确的是()
A. P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强
B. ⅠA族元素的金属性比ⅡA族元素的金属性强
C. 若M+和R2﹣的核外电子层结构相同,则原子序数R>M
D. Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
国家拟于“十二五”期间将SO2的排放量减少8%,研究SO2综合利用意义重大.
(1)已知25℃时:SO2(g)+2CO(g)═2C02(g)+ Sx(s)△H=a kJ•mol﹣1;
Sx(s)△H=a kJ•mol﹣1;
2COS(g)+SO2(g)═2CO2(g)+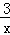 Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
Sx(s)△H=b kJ•mol﹣1.则CO与Sx生成COS反应的热化学方程式是 .
(2)有人设想按如图甲所示装置用废气中的SO2生产硫酸.写出SO2电极的电极反应式 .
(3)提高反应2SO2(g)+O2⇌2SO3(g)△H<0中SO2的转化率是控制SO2排放的关键措施之一.某课外活动小组进行了如下探究:
①T1温度时,在2L的密闭容器中加入4.0molSO2和2.0molO2,5min后反应达到平衡,二氧化硫的转化率为
50%,前5min内SO2的平均反应速率为 .
②在①中的反应达到平衡后,改变下列条件,能使SO2的转化率及SO3的平衡浓度都比原来增大的是 (填序号).
a温度和容器体积不变,充入1.0molHe (g)
b温度和容器体积不变,充入2molSO2和lmolO2
c温度和容器体积不变,充入1.0molSO2
d在其他条件不变时,减小容器的容积
③在其他条件不变的情况下,探究起始时氧气物质的量对2SO2(g)+O2(g)⇌2SO3(g)反应的影响,实验结果如
图乙所示.(图中T表示温度,n表示物质的量):在a、b、c三点所处的平衡状态中,SO2的转化率最高的
是 ,温度T1 T2(填“>”“<”或“一”).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com