
分析 无色澄清的溶液,一定不含有离子Cu2+,因为铜离子为蓝色;
①用pH试纸检验,表明溶液呈现强酸性,碳酸根离子能够与氢离子反应,在溶液中不会存在;
②四氯化碳溶液呈紫红色,说明加入氯水后有碘单质生成,原溶液中一定含有碘离子;
③加入氢氧化钠溶液的过程中没有沉淀生成,说明一定不存在Mg2+;
④加热该碱性溶液生成使湿润的红色石蕊试纸变蓝的气体,该气体为氨气,证明溶液中存在铵根离子,据此结合各小题解答即可.
解答 解:溶液无色,一定不存在离子Cu2+,
①溶液呈现强酸性,碳酸根离子能够与氢离子反应,在溶液中不会存在;
②四氯化碳溶液呈紫红色,原溶液中一定含有碘离子;
③加入氢氧化钠溶液的过程中没有沉淀生成,说明一定不存在Mg2+;
④使湿润的红色石蕊试纸变蓝的气体为氨气,证明溶液中存在铵根离子,
(1)依据此分析可知,溶液中一定存在NH4+、H+、I-,一定不存在Cu2+、CO32-、Mg2+,故答案为:NH4+、H+、I-;Cu2+、CO32-、Mg2+;
(2)NH4+与氢氧根加热反应生成氨气,反应的离子方程式为:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)根据以上分析可知,无法确定原溶液中是否存在K+和Na+,实验室中检验钠离子、钾离子时,通常采用焰色反应,注意观察钾离子的焰色反应火焰颜色时,需要通过蓝色的钴玻璃观察,
故答案为:K+、Na+;作焰色反应实验,若火焰呈黄色证明有Na+存在,再透过蓝色钴玻璃,若火焰呈紫色证明有K+存在.
点评 本题主要考查了常见离子的检验方法,题目难度中等,注意掌握常见离子的化学性质及检验方法,能够根据离子共存、离子反应现象判断离子共存情况,明确检验离子时,必须排除干扰离子,确保检验方案的严密性.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 10:1 | C. | <10:1 | D. | >10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
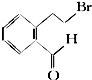 下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图:
下面的框图是应用2-(2-溴乙基)苯甲醛为原料合成有机化合物C和F的流程图: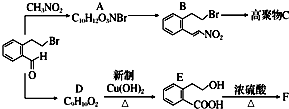
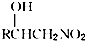
 .
.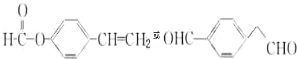 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
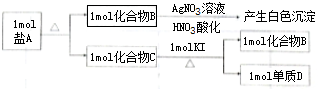
 ;
; ;化合物C中显正价的是碘元素;
;化合物C中显正价的是碘元素;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
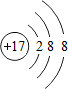
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种氧化物,其中一种纯净的氧化物可用来作录音磁带和 电讯器材的原材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| B. | 在含有Ag+、Fe3+、Cu2+ 的溶液中加入锌粉:Ag+、Cu2+、Fe3+ | |
| C. | 在含有NH4 +、H+、Al3+ 的溶液中,逐滴加入NaOH溶液:H+、Al3+、NH4 +、Al(OH)3 | |
| D. | 在含有Ca(OH)2、NaOH的溶液中,缓慢通入CO2:NaOH、Ca(OH)2、Na2CO3、CaCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com