
分析 (1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②;
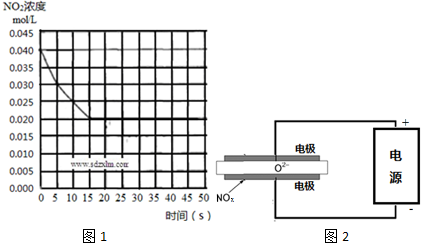
(2)根据=$\frac{△c}{△t}$计算v(NO2),再根据速率之比等于化学计量数之比计算v(O2);
平衡时c(NO2)=0.02mol/L,则△c(O2)=$\frac{1}{2}$×(0.04-0.02)mol/L=0.01mol/L,△c(NO)=△c(NO2)=(0.04-0.02)mol/L=0.02mol/L,代入平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$计算;
平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,而混合气体总质量不变,则总的物质的量增大,说明升高温度平衡向逆反应方向移动,则正反应为放热反应;
(3)慢反应决定整个过程的反应速率;决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢;
(4)若(2)中反应体系,反应开始时使用催化剂,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时二氧化氮的浓度不变;
(5)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-.
解答 解:(1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②,则反应②的热化学方程式为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ,
故答案为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ;
(2)前5min内v(NO2)=$\frac{0.04mol/L-0.03mol/L}{5min}$=0.002mol/(L.min),速率之比等于化学计量数之比,v(O2)=$\frac{1}{2}$v(NO2)=0.001mol/(L.min);
平衡时c(NO2)=0.02mol/L,则△c(O2)=$\frac{1}{2}$×(0.04-0.02)mol/L=0.01mol/L,△c(NO)=△c(NO2)=(0.04-0.02)mol/L=0.02mol/L,平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)c({O}_{2})}$=$\frac{0.0{2}^{2}}{0.0{2}^{2}×0.01}$=100,
平衡后某时刻,升高反应体系的温度,建立新平衡状态后,测的混合气体的平均相对分子质量小于原平衡状态,而混合气体总质量不变,则总的物质的量增大,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,
故答案为:0.001;100;<;
(3)慢反应决定整个过程的反应速率,决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢,
故答案为:②;决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢;
(4)若(2)中反应体系,反应开始时使用催化剂,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时二氧化氮的浓度不变,在图中画出该反应体系反应进程可能的曲线为: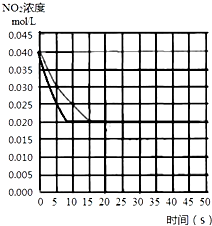 ,
,
故答案为: ;
;
(5)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-,电极反应式为:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-.
点评 本题考查化学平衡计算与影响因素、反应速率计算、盖斯定律应用、电解原理等,难度中等,注意对基础知识理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
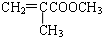 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$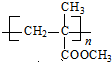 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
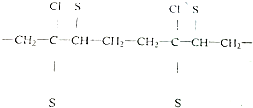
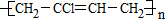 _.
_.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| B. | 利用重结晶可对粗苯甲酸进行提纯 | |
| C. | 不能用核磁共振氢谱来鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知K=$\frac{{c}^{2}C{O}_{2}•{c}^{6}•{H}_{2}}{{c}^{3}{H}_{2}O•cC{H}_{3}C{H}_{2}OH}$,则对应的化学反应可以表示为2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g) | |
| B. | 将某浓度氢氟酸溶液升高温度,氢氟酸的电离度(α)和电离平衡常数Ka都变大 | |
| C. | 常温下,向纯水中加入碳酸钠,水的电离程度变大,KW变大 | |
| D. | 化学平衡常数K与温度有关,随温度的升高,K可能增大也可能减小,或者不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇沸点是78.5℃,将含水酒精直接加热蒸馏可制得无水酒精 | |
| B. | 除去二氧化碳气体中混有的少量氯化氢气体,可以将气体通过饱和碳酸氢钠溶液 | |
| C. | 可以用醋酸除去锅炉中的水垢(主要成分为碳酸钙) | |
| D. | 仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
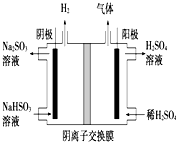 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.不同温度下,反应的平衡常数如表:| 温 度 | 200℃300℃400℃ |
| 平衡常数 | K1 K2 K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| B. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| C. | 氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| D. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com