
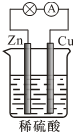
| A. | 反应一段时间后,溶液的酸性减弱 | |
| B. | 电子由Zn经外电路流向Cu,再经硫酸溶液流回Zn | |
| C. | 负极的反应式为2H++2e-═H2↑ | |
| D. | 硫酸作电解质起导电的作用,故浓度保持不变 |
分析 锌、铜和稀硫酸组成的原电池中,锌作负极,负极上锌失电子发生氧化反应;铜作正极,正极上氢离子得电子发生还原反应;电子从负极沿导线流向正极,据此分析.
解答 解:A、锌、铜和稀硫酸组成的原电池中,活泼金属锌作负极,铜作正极,正极氢离子得电子生成氢气,所以消耗氢离子,则溶液的酸性减弱,故A正确;
B、电子从负极锌沿导线流向正极铜,但不经过硫酸溶液,故B错误;
C、锌作负极,负极上锌失电子发生氧化反应,电极反应式为Zn-2e-═Zn2+,故C错误;
D、锌、铜和稀硫酸组成的原电池中,硫酸既提供反应物,又起导电作用,氢离子的浓度减少,故D错误;
故选A.
点评 本题考查了原电池原理,难度不大,注意把握正负极的判断和电极方程式的书写,注意溶液中酸性的变化.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
 )易溶于水,常用做汽水,糖果的添加剂.下列有关说法中,正确的是( )
)易溶于水,常用做汽水,糖果的添加剂.下列有关说法中,正确的是( )| A. | 苹果酸属于烃 | B. | 苹果酸中有3种官能团 | ||
| C. | 苹果酸的分子式是C3H6O5 | D. | 苹果酸能使紫色石蕊溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
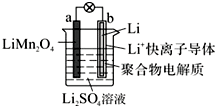
| A. | 充电时,a为阴极 | |
| B. | 充电时,溶液中Li+从b向a迁移 | |
| C. | 电池放电时负极反应为Li-e-═Li+ | |
| D. | 利用该电池电解水,消耗锂14 g可生成气体33.6 L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入含HClO的溶液中生成H2SO4,酸性:HClO>H2SO4 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和NaOH溶液及HF溶液反应,SiO2属于两性氧化物 | |
| D. | SO2使溴水褪色,SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
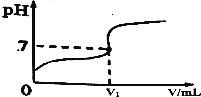 常温下,用0.2000mol/L的MOH溶液滴定10mL同浓度的一元弱酸HA,滴定过程溶液pH随MOH溶液V的变化曲线如图所示HCl溶液,滴定曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.2000mol/L的MOH溶液滴定10mL同浓度的一元弱酸HA,滴定过程溶液pH随MOH溶液V的变化曲线如图所示HCl溶液,滴定曲线如图所示(忽略中和热效应),下列说法不正确的是( )| A. | HA溶液加水稀释后,溶液中$\frac{n(HA)}{n({A}^{-})}$的值减小 | |
| B. | 当V1=10时,MOH一定是弱碱 | |
| C. | 当V1=10时,溶液中水的电离程度最大 | |
| D. | 当V1>10时,溶液中离子浓度关系一定是c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com