
科目:高中化学 来源: 题型:解答题
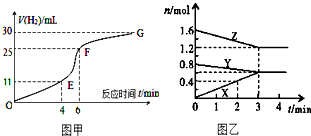 化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除水垢:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 氯乙酸与氢氧化钠溶液共热:CH2ClCOOH+OH-$\stackrel{△}{→}$CH2ClCOO-+H2O | |
| C. | 用新制氢氧化铜悬浊液检验乙醛中的醛基:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O | |
| D. | 苯酚钠溶液中通入少量二氧化硫:C6H5O-+SO2+H2O→C6H5OH+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
科学家预言,燃料电池将是 21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许 H+ 和水分子通过.其工作原理的示意图如下.下列说法错误的是( )| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是 O2+4H++4e-═2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过 2 mol 电子消耗的 CH3OH 为 $\frac{1}{3}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
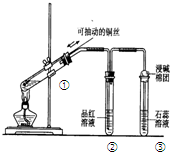
| A. | 上下移动①中铜丝可控制SO2的量 | |
| B. | ②中品红溶液不褪色 | |
| C. | ③中石蕊溶液变蓝色 | |
| D. | 为确认CuSO4生成,向①中加水,观察溶液颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com