
| 1×10-14 |
| 0.01 |


科目:高中化学 来源:2011-2012学年河北省正定中学高二第一次考试理科化学试卷(带解析) 题型:计算题
(13分)在25℃时,将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g) 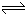 xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
xC(g)+2D(g) ;△H>0,经5min后测知D的浓度为0.5mol/L,
A、B的物质的量浓度之比为3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的物质的量浓度是 ;
反应开始前容器中的A、B的物质的量:n(A)= n(B)=
(2)x的值为 ;5min内B的平均反应速率 ;
(3)下列措施能使正反应速率增大的是 (不定项选择)
A. 只增大A的浓度 B.增大反应的温度
C. 向容器中通入一定体积的He,增大反应的压强 D. 使用催化剂
(4)若改用3L的密闭容器,盛放与上述相同量的A、B气体,则达到平衡后,A和B的物质的量浓度的比值 3:5(填“>”“=”“<”)。
查看答案和解析>>
科目:高中化学 来源:2015届云南省高二上学期期中考试化学试卷(解析版) 题型:填空题
(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近 。
(3)25℃时,下列四种溶液中,①pH=0的盐酸 ②0.1 mol·L–1的盐酸 ③0.01 mol·L–1的NaOH溶液 ④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是: (填字母)
A.1︰10︰100︰1000 B.0︰1︰12︰11
C.14︰13︰12︰11 D.14︰13︰2︰3
(4)某温度(t℃)时,测得0.01mol·L-1 的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH- )=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) = ;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) = ;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)= 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二第一次考试理科化学试卷(解析版) 题型:计算题
(13分)在25℃时,将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)  xC(g)+2D(g)
;△H>0,经5min后测知D的浓度为0.5mol/L,
xC(g)+2D(g)
;△H>0,经5min后测知D的浓度为0.5mol/L,
A、B的物质的量浓度之比为3:5,C的平均反应速率是0.1mol/(L·min),求:
(1)此时A的物质的量浓度是 ;
反应开始前容器中的A、B的物质的量:n(A)= n(B)=
(2)x的值为 ;5min内B的平均反应速率 ;
(3)下列措施能使正反应速率增大的是 (不定项选择)
A. 只增大A的浓度 B.增大反应的温度
C. 向容器中通入一定体积的He,增大反应的压强 D. 使用催化剂
(4)若改用3L的密闭容器,盛放与上述相同量的A、B气体,则达到平衡后,A和B的物质的量浓度的比值 3:5(填“>”“=”“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com