
【题目】欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+__K2Cr2O7+__→__CO2↑+__K2SO4+__Cr2(SO4)3+_H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116 kJmol-1
CH3OH(g) △H1=-116 kJmol-1
①下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
②已知:CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJmol-1;
O2(g)=CO2(g) △H2=-283 kJmol-1;
H2(g)+![]() O2(g)=H2O(g) △H3=-242 kJmol-1
O2(g)=H2O(g) △H3=-242 kJmol-1
则表示1 mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
③在容积为1 L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1 mol)与CO平衡转化率的关系。

请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是______;
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___。
CH3OH(g)的平衡常数K=___。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___。
【答案】3 2 8H2SO4 3 2 2 8 CD CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H=-651 kJ/mol 270℃ 4 L2mol-2 1.6×10-5 mol/L
O2(g)=CO2(g)+2H2O(g) △H=-651 kJ/mol 270℃ 4 L2mol-2 1.6×10-5 mol/L
【解析】
(1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合化合价升降总数相等以及质量守恒定律配平;
(2)①根据平衡移动原理进行判断,温度升高,反应速率加快,使用催化剂,反应速率加快;
②根据盖斯定律和题中热化学方程式写出甲醇完全燃烧生成二氧化碳的热化学方程式;
③ⅰ)根据温度对平衡移动的影响分析;
ⅱ)根据平衡常数表达式和一氧化碳的转化率求算;
(3)根据Ksp=c(Ca2+)c(CO32-)计算。
(1)反应中C元素的化合价由0升高为+4价,一个碳原子化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由于产物中有Cr2(SO4)3,所以未知的反应物为H2SO4,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,故缺项由前到后依次为:3、2、8H2SO4、3、2、2、8;
(2)①A. 随时将CH3OH与反应混合物分离,反应速率减小,A错误;
B. 温度降低,反应速率变小,B错误;
C. 压强增大,反应速率加快,C正确;
D. 使用催化剂,反应速率加快,D正确;
故合理选项是CD;
②(i)根据反应①CO(g)+2H2(g)![]() CH3OH(g) △H1=-116 kJmol-1,
CH3OH(g) △H1=-116 kJmol-1,
(ii)CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJmol-1;
O2(g)=CO2(g) △H2=-283 kJmol-1;
(iii)H2(g)+![]() O2(g)=H2O(g) △H3=-242 kJmol-1,
O2(g)=H2O(g) △H3=-242 kJmol-1,
根据盖斯定律:(ii)+(iii)×2-(i)得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) △H=-651 kJmol-1;
O2(g)=CO2(g)+2H2O(g) △H=-651 kJmol-1;
③ⅰ)该反应的正反应为放热反应,温度升高,平衡向吸热的逆反应方向移动,使CO的转化率越小,所以曲线Z表示的温度为270℃;
ⅱ)化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以该反应的平衡常数K=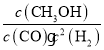 ,反应容器容积为1 L,初始时CO为1 mol,H2为1.5 mol;a点时,CO转化率50%,反应消耗CO物质的量为1 mol×50%=0.5 mol,消耗氢气1 mol,剩余n(CO)=0.5 mol,n(H2)=1.5 mol-1 mol=0.5 mol,生成0.5 mol甲醇,a点各组分的浓度是:c(CH3OH)=0.5mol/L,c(CO)=0.5mol/L,c(H2)=0.5 mol/L,带入平衡常数表达式可得:K=
,反应容器容积为1 L,初始时CO为1 mol,H2为1.5 mol;a点时,CO转化率50%,反应消耗CO物质的量为1 mol×50%=0.5 mol,消耗氢气1 mol,剩余n(CO)=0.5 mol,n(H2)=1.5 mol-1 mol=0.5 mol,生成0.5 mol甲醇,a点各组分的浓度是:c(CH3OH)=0.5mol/L,c(CO)=0.5mol/L,c(H2)=0.5 mol/L,带入平衡常数表达式可得:K=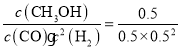 L2mol-2=4 L2mol-2;
L2mol-2=4 L2mol-2;
(3)Na2CO3溶液的浓度为7×10-4 mol/L,等体积混合后溶液中c(CO32-)=![]() ×7×10-4 mol/L=3.5×10-4 mol/L;根据Ksp=c(Ca2+)c(CO32-)=2.8×10-9可知,c(Ca2+)=
×7×10-4 mol/L=3.5×10-4 mol/L;根据Ksp=c(Ca2+)c(CO32-)=2.8×10-9可知,c(Ca2+)=![]() mol/L=0.8×10-5 mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×0.8×10-5 mol/L=1.6×10-5 mol/L。
mol/L=0.8×10-5 mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×0.8×10-5 mol/L=1.6×10-5 mol/L。


科目:高中化学 来源: 题型:
【题目】锂空气电池是一种新型的二次电池,其放电时的工作原理如图所示。下列说法正确的是( )
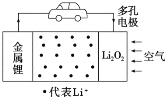
A.电解液中,Li+由多孔电极迁移向锂电极
B.该电池放电时,负极发生了还原反应
C.充电时,电池正极的反应式为Li2O2-2e-=2Li++O2↑
D.电池中的电解液可以是有机电解液或稀盐酸等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A. 同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B. BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C. BaSO4和BaCO3共存的悬浊液中, 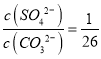
D. BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】曲美替尼是一种抑制黑色素瘤的新型抗癌药物,下面是合成曲美替尼中间体G的反应路线:

已知:①D分子中有2个6元环;

请回答:
(1)化合物A的结构简式___________。A生成B的反应类型___________。
(2)下列说法不正确的是___________。
A.B既能表现碱性又能表现酸性
B.1moC在碱溶液中完全水解最多可以消耗4 molOH-
C.D与POCl3的反应还会生成E的一种同分异构体
D.G的分子式为C16H18O3N4
(3)写出C→D的化学方程式____________________________________________。
(4)X是比A多2个碳原子的A的同系物,写出符合下列条件的X可能的结构简式:_______________________________________________________。
①1H-NMR谱显示分子中有3种氢原子,②IR谱显示分子中有苯环与-NH2相连结构
(5)流程中使用的DMF即N,N-二甲基甲酰胺结构简式为 ,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
,是常用的有机溶剂。设计以甲醇和氨为主要原料制取DMF的合成路线(用流程图表示,其他无机试剂任选)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 通入
通入![]() 的KOH溶液中。溶液中水电离出的
的KOH溶液中。溶液中水电离出的![]() 离子浓度
离子浓度![]() 与通入的
与通入的![]() 的体积
的体积![]() 的关系如图所示。下列叙述不正确的是
的关系如图所示。下列叙述不正确的是
 A
A
A.a点溶液中:水电离出的![]()
B.b点溶液中:![]()
C.c点溶液中:![]()
D.d点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表化学键,如单键、双键等)。

(1)该物质的结构简式为___________________________。
(2)该物质中所含官能团的名称为________________。
(3)下列物质中,与该物质互为同分异构体的是________(填序号,下同),与该物质互为同系物的是________。
①CH3CH![]() CHCOOH ②CH2
CHCOOH ②CH2![]() CHCOOCH3
CHCOOCH3
③CH3CH2CH![]() CHCOOH ④CH3CH(CH3)COOH
CHCOOH ④CH3CH(CH3)COOH
Ⅱ.某化合物的分子式为C5H12O,经分析数据知,分子中有两个—CH3,两个—CH2—、一个![]() 和一个—OH。则:
和一个—OH。则:
(1)它的可能结构有________种。
(2)请写出一种它可能的结构简式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质( )

A. A是C3H6;B是C6H6
B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6
D. A是C3H6;B是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是八种环状的烃类物质:
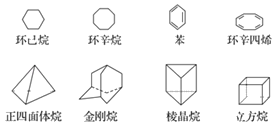
(1)互为同分异构体的有___和___、___和___(填写名称)。
(2)正四面体烷的二氯取代产物有___种;金刚烷的一氯取代产物有___种。
(3)化合物A的相对分子质量为86,所含碳的质量分数为55.8%,氢的质量分数为7.0%,其余为氧。
①A的分子式为___。
②A有多种同分异构体,写出五个同时满足下列条件的同分异构体的结构简式:
a.能发生水解反应b。能使溴的四氯化碳溶液褪色
___、___、___、___、___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com