
| B的变化量 |
| B的起始量 |
| B的变化量 |
| B的起始量 |
| 0.8 |
| 1.2 |
| △C |
| △t |
| ||
| 4min |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、NH3 分子的空间构型为平面三角形,是非极性分子 |
| B、过氧化钠属于离子化合物,其晶体中含有非极性共价键 |
| C、水分子间存在氢键,所以水的化学性质稳定 |
| D、H-C≡C-H中的σ键和π键之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示向A中充入2mol X、2mol Y,向B中充入1mol X、1mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+2W(g);△H<0.达到平衡时,V(A)=1.2a L.
如图所示向A中充入2mol X、2mol Y,向B中充入1mol X、1mol Y,起始时,V(A)=V(B)=a L.在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+2W(g);△H<0.达到平衡时,V(A)=1.2a L.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.5g | B、9g |
| C、27g | D、0.33mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
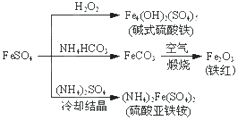
A、FeCO3转化为铁红的化学方程式:4FeCO3+O2
| ||||
| B、碱式硫酸铁因能水解产生Fe(OH)3胶体,故可用作净水剂 | ||||
| C、为检验暴露在空气中的(NH4)2Fe(SO4)2是否已被氧化,可选用KSCN溶液 | ||||
| D、常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q |
| B、若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| C、若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
| D、保持其它条件不变,升高温度,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com