
| 1 |
| 2 |
| 温度(℃) | 300 | 400 | 500 |
| K② | 3.1×1015 | 1.66×1014 | 5.3×1013 |
| K③ | 4.0×1020 | 3.6×1018 | 5.7×1017 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
| A、2.5mol?L-1 28.57% |
| B、2.2mol?L-1 23.07% |
| C、1.5mol?L-1 24.55% |
| D、2.5mol?L-1 18.37% |
查看答案和解析>>
科目:高中化学 来源: 题型:
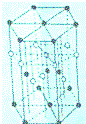 已知:X、Y、Z、W是四种短周期元素,它们的原子序数依次增大.其中X、Y、Z同周期,X与W同主族;X与Z形成的常见化合物之一常被用于高炉炼铁,且X、Z原子的L层都有2个未成对电子;Q+离子M层3d轨道电子为全充满状态.请回答下列问题:
已知:X、Y、Z、W是四种短周期元素,它们的原子序数依次增大.其中X、Y、Z同周期,X与W同主族;X与Z形成的常见化合物之一常被用于高炉炼铁,且X、Z原子的L层都有2个未成对电子;Q+离子M层3d轨道电子为全充满状态.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
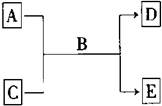 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下: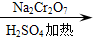 CH3CH2CH2CHO
CH3CH2CH2CHO| 沸点/℃ | 密度/(g?cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、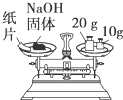 称量NaOH固体 |
B、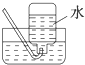 收集氯气 |
C、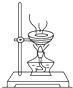 加热蒸发Nacl溶液 |
D、 向容量瓶中转移溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com