
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
分析 毒品是指鸦片、海洛因、吗啡、大麻、可卡因,以及国务院规定管制和其他能够使人形成瘾癖的麻醉药品和精神药品,大致可分鸦片类、大麻类、可卡因、冰毒、致幻剂等五大类,据此解答.
解答 解:毒品是指鸦片、海洛因、吗啡、大麻、可卡因,以及国务院规定管制和其他能够使人形成瘾癖的麻醉药品和精神药品,大致可分鸦片类、大麻类、可卡因、冰毒、致幻剂等五大类,
所以麻古(冰毒片剂)、K粉(氯胺酮)、大麻(四氢大麻酚)都属于毒品,抗酸药是能够中和胃液中过量的盐酸药物,不是毒品;
故选:D.
点评 本题考查学生对毒品的认识,学生应明确常见的毒品及其对人类健康的危害,题目难度不大,侧重于考查学生对化学知识的掌握情况.


科目:高中化学 来源: 题型:实验题
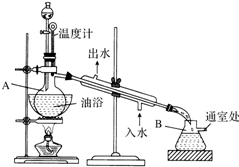 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
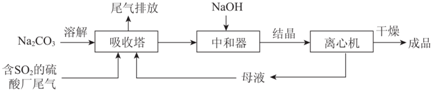
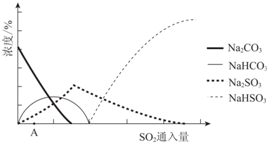
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
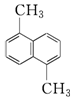 物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )
物质A的分子式为C12H12,结构简式为如图,已知苯环上的二溴代物有9种同分异构体,由此推测A的苯环上的四溴代物的异构体数目有( )| A. | 9种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与Na2O | B. | Na2O2 | C. | Na2O2与Na | D. | Na和Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
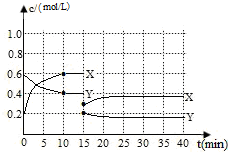 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com