
����Ŀ������ijѧ����0.1000mol/L NaOH��Һ�ζ�δ֪Ũ�ȵ�������Һ��������ɷֽ�Ϊ���¼�����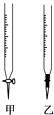
A�����ζ����Ƿ�©ˮ
B��������ˮϴ�ɾ��ζ���
C��ȡ�¼�ʽ�ζ����ñ���NaOH��Һ��ϴ����Һע���ʽ�ζ��ܡ�0���̶�����2��3cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ������0���̶Ȼ�0���̶�����
D���ô��ⶨ����Һ��ϴ��ʽ�ζ���
E������ʽ�ζ���ȡϡ����20.00mL��ע����ƿ�У������̪
F������ƿ���ڵζ������棬ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ�����ڿ̶�
G����ȡ��ƿ�����ظ�����һ��
���������գ�
��1������F��Ӧ��ѡ��ͼ�� �ζ��ܣ����ţ���
��2���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲� ��
A���ζ�����Һ��ı仯 B����ƿ����Һ��ɫ�ı仯
�ζ��յ���Һ��ɫ�ı仯�� ����ָʾ����Ϊ��������ɫ�ı仯�� ��
��3���ζ���������ʾ��
�ζ����� | ����Һ���/mL | ����Һ�����/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | |||
�� | 20 | 1.02 | 21.03 | |
�� | 20 | 2.00 | 25.00 | |
�� | 20 | 0.60 | 20.59 | |
�ζ������ϴ���ǵ� ��ʵ�飬����������Ŀ���ԭ���� ��
A����ʽ�ζ�����װҺǰδ�ñ�NaOH��Һ��ϴ2��3��
B���ζ���ʼǰ��ʽ�ζ��ܼ��첿�������ݣ��ڵζ��յ����ʱδ��������
C���ζ���ʼǰ��ʽ�ζ��ܼ��첿��û�����ݣ��ڵζ��յ����ʱ���ּ��첿��������
D���ﵽ�ζ��յ�ʱ��������Һ��Һ����͵����
E���ζ������У���ƿҡ����̫���ң�������ЩҺ�ηɽ�����
��4���������Ũ��Ϊmol/L��
���𰸡�
��1����
��2��B,��ɫ��dz��ɫ�Ұ�����ڲ���ɫ,��ɫ���ɫ
��3��2,ABD
��4��0.1000
����������1������F��Ҫ����ƿ���ڼ�ʽ�ζ������棬Ӧ��ѡ��ͼ���ҵζ��ܡ�
��2���ζ�ʱ�ߵα�ҡ����ƿ���۾�Ӧ�۲���ƿ����Һ��ɫ�ı仯��ѡB����̪��ָʾ��ʱ���ζ��յ���Һ��pH��8~10֮�䣬������Һ��ɫ�ı仯����ɫ��dz��ɫ�Ұ�����ڲ���ɫ����ָʾ����Ϊ���ȣ��ζ��յ���Һ��pH��3.1~4.4֮�䣬����ɫ�ı仯�Ǻ�ɫ���ɫ��
��3���ɱ�����Ϣ��֪��3�εζ��ֱ����ı�Һ�����Ϊ20.01 mL��23.00 mL��19.99 mL�����Եζ������ϴ���ǵ�2��ʵ�顣A����ʽ�ζ�����װҺǰ��δ�ñ�NaOH��Һ��ϴ2��3�� �����ҺŨ�ȱ�С���ζ�ʱ���ı�Һ���ƫ��B���ζ���ʼǰ��ʽ�ζ��ܼ��첿�������ݣ��ڵζ��յ����ʱδ�������ݣ������ݵ����Ҳ��Ϊ��Һ�������ĩ����ƫ��C���ζ���ʼǰ��ʽ�ζ��ܼ��첿��û�����ݣ��ڵζ��յ����ʱ���ּ��첿�������ݣ����Һ��ĩ����ƫС��D���ﵽ�ζ��յ�ʱ��������Һ��Һ����͵���������Һ��ĩ����ƫ��E���ζ������У���ƿҡ����̫���ң�������ЩҺ�ηɽ���������������С�����±���Һ������С�� ������������ɵ�2�εζ����ϴ�Ŀ���ԭ���� ABD��
��4���ɵ�1��2���εζ����ñ�Һ�����ƽ��ֵ20.00 mL�ͱ�Һ��Ũ��0.1000mol/L �����ݲμӷ�Ӧ��������������Ƶ����ʵ�����ȣ����Լ������20.00 mL���������Ũ��Ϊ ![]() 0.1000 mol/L��
0.1000 mol/L��
�����㾫����������Ҫ����������к͵ζ������֪ʶ�㣬��Ҫ�����к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ������ȷ�����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ˮ�μӣ���������������ԭ��Ӧ����ˮ�Ȳ������������ֲ�����ԭ�����ǣ� ��
A. Na2O + H2O = 2NaOH B. 2Na + 2H2O = 2NaOH + H2 ��
C. C12 + H2O = HC1O + HC1 D. C + H2O ![]() CO + H2 ��
CO + H2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͨ��BaCl2��Һ��δ���������ɣ�Ȼ��ͨ�������壬�г������ɣ���ס������岻������
A.SO2��H2SB.SO2��NO2 C.NH3��CO2 D.CO2��SO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.1mol�������������22.4L/mol
B.1mol H2��������1g������ռ�������22.4L/mol
C.�ڱ�״���£�1mol�κ�������ռ�������ԼΪ22.4L
D.�ڱ�״���£�1mol�κ�������ռ�������ԼΪ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȥ�����е�Mg2+ ��Ca2+ ��SO42-�����ʣ����м����Լ� (�����) ˳��������( )
A. NaOH��BaCl2��Na2CO3�����ˡ�����������ᾧ
B. BaCl2��Na2CO3��NaOH�����ˡ�����������ᾧ
C. Na2CO3��BaCl2��NaOH�����ˡ�����������ᾧ
D. BaCl2��NaOH��Na2CO3�����ˡ�����������ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.�����ȼ����Ϊ890.3KJ?mol��1 �� �����ȼ���ȵ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=��890.3 kJ?mol��1
B.500�桢30 MPa �£���0.1 mol N2 �� 0.3 mol H2 �����ܱ������г�ַ�Ӧ����NH3��g��������3.86 KJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g�� ![]() ? 2NH3��g����H=��38.6 KJ?mol��1
? 2NH3��g����H=��38.6 KJ?mol��1
C.��֪1 gҺ̬�º�����Һ̬�������ⷴӦ���ɵ�����ˮ����ʱ�ų�20.05 kJ���������º������ⷴӦ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l���TN2��g��+4H2O��g����H=��641.6 KJ?mol��1
D.CO��g����ȼ������283.0 KJ?mol��1 �� ��2CO2��g���T2CO��g��+O2��g�� ��Ӧ�ġ�H=+283.0 KJ?mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����������ijЩ�������Է������������������ſ������ռ����ǣ�������
A. 16 B. 28 C. 44 D. 64
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ���ǣ� ��
A.����������ӵĻ�ѧʽ��ClO��
B.�ɱ��ķ���ʽ��H2O
C.��ϩ�Ľṹ��ʽ��CH2CH2
D.�Ҵ��Ľṹ��ʽ��C2H6O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��100����¶��£������漰����Һ�¶Ⱦ�Ϊ100�棩��ˮ�����ӻ�KW=1��10��12 �� ����˵����ȷ���ǣ� ��
A.0.001 mol/L��NaOH��ҺpH=9
B.0.1 mol/L��H2SO4��ҺpH=1
C.0.005 mol/L��H2SO4��Һ��0.01 mol/L��NaOH��Һ�������ϣ������ҺpHΪ6����Һ������
D.��ȫ�к�pH=3��H2SO4��Һ50 mL����ҪpH=11��NaOH��Һ50 mL
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com