
【题目】下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
A.甲烷、辛醛B.丙炔、苯乙烯C.甲醛、甲酸甲酯D.苯、甲苯
【答案】AC
【解析】
A.甲烷的分子式为CH4,分子中的含碳量![]() ×100%=75%,辛醛的分子式为C8H16O,分子中的含碳量
×100%=75%,辛醛的分子式为C8H16O,分子中的含碳量![]() ×100%=75%,含碳量相等,符合题意,故A选;
×100%=75%,含碳量相等,符合题意,故A选;
B.丙炔的分子式为C3H4,分子中的含碳量![]() ×100%=90.0%,苯乙烯的分子式为C8H8,分子中的含碳量
×100%=90.0%,苯乙烯的分子式为C8H8,分子中的含碳量![]() ×100%=92.3%,含碳量不相等,不符合题意,故B不选;
×100%=92.3%,含碳量不相等,不符合题意,故B不选;
C.甲醛的分子式为CH2O,分子中的含碳量![]() ×100%=40%,甲酸甲酯的分子式为C2H4O2,分子中的含碳量
×100%=40%,甲酸甲酯的分子式为C2H4O2,分子中的含碳量![]() ×100%=40%,含碳量相等,符合题意,故C选;
×100%=40%,含碳量相等,符合题意,故C选;
D.苯的分子式为C6H6,分子中的含碳量![]() ×100%=92.3%,甲苯的分子式为C7H8,分子中的含碳量
×100%=92.3%,甲苯的分子式为C7H8,分子中的含碳量![]() ×100%=91.3%,含碳量不相等,不符合题意,故D不选;
×100%=91.3%,含碳量不相等,不符合题意,故D不选;
故选AC。


科目:高中化学 来源: 题型:
【题目】I.字母A~K代表常见物质,在一定条件下能发生如图所示变化。
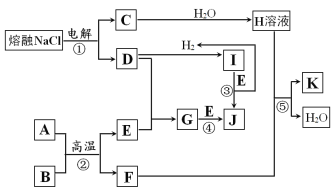
已知:反应②中A为黑色粉末,B为金属单质,且n(A):n(B)=3:2。反应③和④均在水溶液中进行。
(1)写出J的名称:___。
(2)写出反应②的化学方程式:___。
(3)写出反应⑤的离子方程式:___。
II.某研究性学习小组的同学以Fe(NO3)3溶液来探究Fe3+能否氧化Ag为题。他们选用少量的Fe(NO3)3溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
请你判断:以上实验能否得到相关结论。
若你认为能得出结论,请简述理由:___。
若你认为不能得出结论,请在此实验基础上,再继续实验(试剂任选),直至得出相关结论。请设计实验(写出实验操作、现象和结论):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下实验测得4g液态甲醇(CH3OH)在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出90.8kJ的热量。试写出甲醇燃烧热的热化学方程式______。
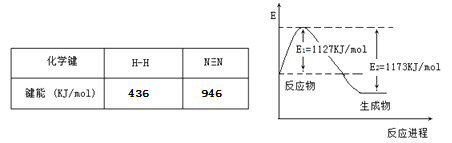
(2)现己知N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化如图所示。根据下列键能数据计算N-H键键能为_____kJmol-1。
(3)用如图所示装置进行中和热测定实验,请回答下列问题:
①仪器A的名称为_______________。
②取50mL0.1molL-1 HCl溶液与50mL0.1molL-1 NaOH溶液在小烧杯中进行中和反应,通过实验并计算可得中和热为54.8kJmol-1,上述实验数值与57.3kJmol-1有偏差,产生此偏差的原因可能是_______(填字母序号)。
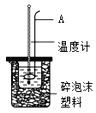
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
c.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
③若用50mL 0.1molL-1 CH3COOH溶液代替HCl溶液进行上述实验,测得反应前后温度的变化值会_____________(填“偏大”、“偏小”、“不受影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:[FeCl4(H2O)2]-为黄色,下列实验所得结论不正确的是( )
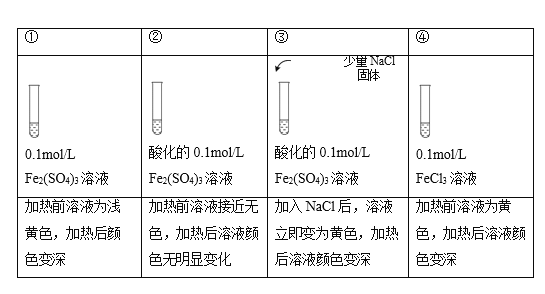
注:加热为微热,忽略体积变化。
A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3
B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响
C.实验③中,存在可逆反应: Fe3+ + 4Cl-+ 2H2O ![]() [FeCl4(H2O)2]-
[FeCl4(H2O)2]-
D.实验④,可证明升高温度,Fe3+水解平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种不同的物质中均含有同一种元素,它们之间的转化关系如图示(部分反应物及生成物已略去)。下列说法错误的是:
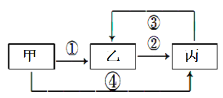
A.若甲为气态氢化物,乙为淡黄色固体,则丙具有漂白性
B.若甲为气体单质,乙为含有极性共价键的非极性分子,则反应②为吸热反应
C.若甲为金属氧化物,乙的水溶液呈酸性,则丙既能与强酸又能与强碱反应
D.若甲为金属单质,反应④为置换反应,则往乙溶液中滴加KSCN,溶液变为血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应3NaH+Fe2O3![]() 2Fe+3NaOH。
2Fe+3NaOH。
(1)基态Fe原子核外共有__种运动状态不相同的电子;Fe3+的价电子排布图为__。
(2)1molNaOH含有σ键数目为__;Fe3+可以和SCN-形成配合物,该反应是典型的可逆反应,说明配位原子配位能力__(填“强”或“弱”)。
(3)上述反应中含Na的化合物晶体类型均为__晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
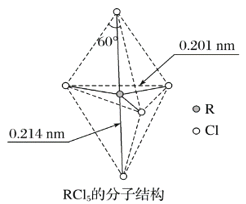
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。

(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com