
请完成下列问题:
(1)若A通常状态下为固态单质,A→E分别为(写化学式):
A_________,B_________,C_________,D_________,E_________。
(2)若A通常状态下为气态单质,则A→E分别为(写化学式):
A_________,B_________,C_________,D_________,E_________。
(3)写出(2)中物质间转化的离子方程式E→C:__________________。
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:


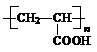
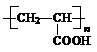
| 浓H2SO4 |
| △ |
 +H2O
+H2O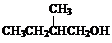
| 浓H2SO4 |
| △ |
 +H2O
+H2O



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
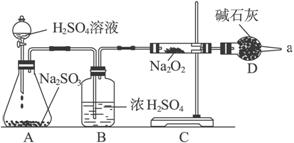
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
Ⅰ.测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,其反应的离子方程式为:
4![]() +5HCHO+12H+====4Mn2++5CO2↑+11H2O
+5HCHO+12H+====4Mn2++5CO2↑+11H2O
2![]() +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
Ⅱ.测定装置:部分装置如下图所示(a、b为止水夹)
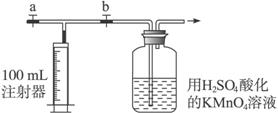
Ⅲ.实验步骤:
①检查装置气密性(气密性良好)。
②用A仪器准确移取25.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6 mol·L-1 H2SO4溶液备用。
③将2.00×10-3 mol·L-1的草酸标准溶液置于A仪器中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次(共5次)。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2—3次,并将洗涤液全部转入锥形瓶)。
⑥用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液体积。
⑦再重复实验2次。
Ⅳ.数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00 mL):
装修后第n天 | 草酸溶液/mL | 甲醛的浓度/mg·m-3 | |||
1 | 2 | 3 | 平均值 | ||
1 | 15.86 | 15.72 | 15.67 | 15.75 |
|
7 | 26.24 | 26.36 | 26.31 | 26.30 |
|
30 | 30.90 | 30.67 | 30.81 | 30.79 |
|
请完成下列问题:
(1)A仪器名称是_________________ 。
(2)步骤④如果压送气体时速度过快,可能会产生什么不利后果?
_____________________________________________________________________。
(3)步骤⑤如果没有润洗,所测甲醛的含量将____________(填“偏高”“偏低”或“无影响”)。
(4)本实验是否需要指示剂(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象):___________________________________________________________________。
(5)假设KMnO4溶液的物质的量浓度为c1 mol·L-1,所取KMnO4溶液的体积为V1 mL;草酸溶液的物质的量浓度为c2 mol·L-1,消耗草酸溶液的平均体积为V2 mL。
则:计算室内空气中甲醛浓度(mg·m-3)的代数式为____________,第30天室内空气中甲醛浓度为____________,并判断此时主人____________(填“能”或“否”)入住。
查看答案和解析>>
科目:高中化学 来源:2011届甘肃省天水市三中高三第六次检测理综化学部分 题型:填空题
A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电 子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为___________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4 ─ 空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是__________ _________________________。
_________________________。
(5)已知:2CD2(g)  C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
C2D4(g);△H<0。在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。 
① a、b、c、d四个点中,化学反应处于平衡状态的是_ ______点。
______点。
② 25 min时,增加了_______(填物质的化学式)________mol。
③ a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是_______(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com