
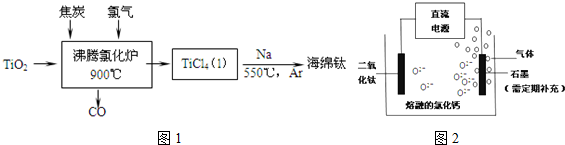
分析 (1)①根据沸腾炉中流程可知反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,依据在守恒配平书写;
②将已知方程式换算成目标方程式,焓变进行相应的改变,结合盖斯定律计算得到;
③水解是结合水电离出的氢氧根离子或氢离子生成弱电解质的过程;
(2)①阴极上得电子发生还原反应;
②阴极上加入的物质应该具有还原性,反应后的生成物没有污染;
(3)A、根据反应物和生成物的能量变化确定焓变;
B、根据温度判断,在不同温度区域,TiI4的量是否发生改变;
C、温度不同,反应方程式不同,产物不同
D、在提纯过程中,根据反应确定I2的量是否变化.
解答 解:(1)①沸腾炉中流程可知反应物为氯气、碳和TiO2,反应生成TiCl4和一氧化碳,反应的化学方程式为:TiO2+2C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2C+2Cl2$\frac{\underline{\;900℃\;}}{\;}$TiCl4+2CO;
②(I) Ti(s)+2Cl2(g)=TiCl4(l)△H=a kJ/mol;
(II) 2Na(s)+Cl2(g)=2NaCl(s)△H=bkJ/mol;
(III) Na(s)=Na(l)△H=ckJ/mol,
将方程式2(II)-(I)-4(III)得TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s),△H=2b-4c-a;
故答案为:2b-4c-a;
③TiCl4遇水强烈水解,钛离子结合氢氧根离子形成氢氧化钛出的和氯化氢,反应进行彻底,反应的化学方程式TiCl4+4H2O?Ti(OH)4↓+4HCl↑或TiCl4+3H2O=H2TiO3↓+4HCl↑,
故答案为:TiCl4+4H2O=Ti(OH)4↓+4HCl↑或TiCl4+3H2O=H2TiO3↓+4HCl↑;
(2)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连;电极反应式为TiO2+4e-=Ti+2O2-,阴极上加入的物质应该具有还原性且是气体,反应后的生成物没有污染,水没有污染,所以该气体是氢气,
故答案为:负;TiO2+4e-=Ti+2O2-;H2;
(3)A、大多数混合反应是放热反应,该反应的正反应也是放热反应,则该反应正反应的△H<0,故A错误;
B、高于400℃,钛和氯气反应生成四氯化钛,在1250℃四氯化钛分解,所以在不同温度区域,TiI4的量不同,故B错误;
C、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的作用是将粗钛从低温区转移到高温区,故C正确;
D、在提纯过程中,高于400℃,碘和钛反应生成四氯化钛,在1250℃四氯化钛分解生成碘和钛,所以I2的量不变,可以循环利用,故D正确;
故选CD.
点评 本题考查了金属的冶炼、电极反应式的书写、热化学反应等知识点,注意焓变的有关计算、电极反应式的书写是高考的热点,应重点掌握,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )合成聚芳酯E的路线:
)合成聚芳酯E的路线: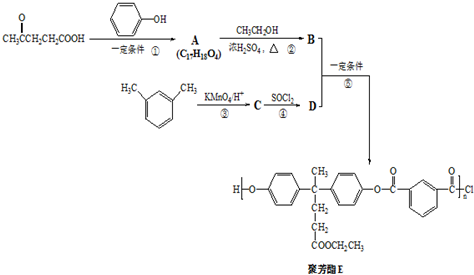
 →
→ +SO2+HCl
+SO2+HCl +R′OH→
+R′OH→ +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基) .
. .
. 结构 ④苯环上只有2个取代基在上述同分异构体中,写出其中任一种与足量NaOH溶液共热反应的化学方式:
结构 ④苯环上只有2个取代基在上述同分异构体中,写出其中任一种与足量NaOH溶液共热反应的化学方式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2能与碱反应 | Cl2可用于制漂白粉 |
| B | Si有导电性 | SiO2可用于制光导纤维 |
| C | N2性质稳定 | N2可作为食品保护气 |
| D | 锌的金属性比铁强 | 轮船外壳上焊接若干锌块以减缓其腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,关于阿司匹林的叙述正确的是( )
,关于阿司匹林的叙述正确的是( )| A. | 阿司匹林属于抗生素 | |
| B. | 阿司匹林不能发生水解反应 | |
| C. | 阿司匹林具有解热镇痛作用 | |
| D. | 阿司匹林之所以成为经典药物是因为服用该药物没有不良反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④ | B. | ③②①④ | C. | ③①④② | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl的摩尔质量是58.5 g | |
| B. | 含1 mol NaCl的溶液中约含有6.02×1023个Cl- | |
| C. | 1 mol NaCl的质量是58.5 g•mol-1 | |
| D. | 58.5 g NaCl所含Na+和Cl-共1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com