
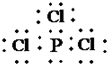 .
.分析 由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E 中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和“C元素的最外层电子数比次外层电子数少4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多3”,所以D为P,所以只能B为Al,A为Na.E可能为Cl或S,当E为S时,不满足“A、B、E 3种原子最外层共有11个电子”,所以E只能为Cl,根据题目要求和元素性质和元素周期律知识来解答.
解答 解:由“这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水”可知,在A、B、E 中必定有Al,由“A、B、C、D、E为原子序数依次增大的短周期元素”和“C元素的最外层电子数比次外层电子数少4”可知,C为Si,又由“D元素原子次外层电子数比最外层电子数多3”,所以D为P,所以只能B为Al,A为Na.E可能为Cl或S,当E为S时,不满足“A、B、E 3种原子最外层共有11个电子”,所以E只能为Cl.
(1)由以上分析可知A为Na,B为Al,C为Si,D为P,E为Cl,
故答案为:钠;硅;
(2)C为Si,D为P,非金属性P>Si,元素的非金属性越强,最高价氧化物的水化物的酸性越强,则H3PO4的酸性强;
故答案为:H3PO4;
(3)D为P,E为Cl,PCl3中所有原子均达到稳定结构,其电子式为: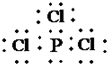 ;
;
故答案为: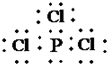 ;
;
(4)A、B两元素最高价氧化物的水化物分别为NaOH和Al(OH)3,相互反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O.
点评 本题考查原子结构、位置与性质,综合考查元素周期表、周期律以及原子结构的特点,注意把握原子结构特点为解答该题的关键,题目难度中等.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
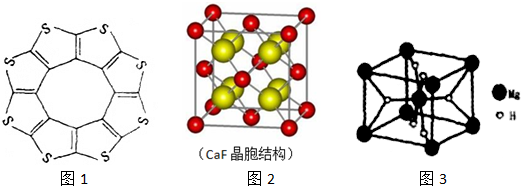
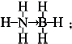 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在澄清透明的溶液中:H+、Na+、SO42-、Cu2+ | |
| B. | 在$\frac{{K}_{w}}{c(O{H}^{-})}$=1 mol•L-1的溶液中:Na+、NH4+、I-、CO32- | |
| C. | 在0.1mol•L-1NaHSO4溶液中:K+、Fe2+、C1-、NO3- | |
| D. | 在能使甲基橙显黄色的溶液中:Ca2+、Ba2+、Br-、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
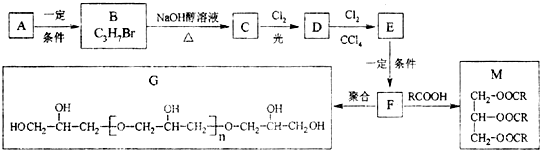
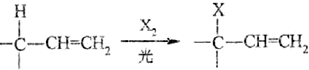
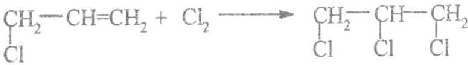 .
.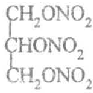 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠溶于水的反应:2Na+2H2O═2NaOH+H2↑ | |
| B. | 碳酸钠溶液和稀醋酸反应:CO2-3+2H+═H2O+CO2↑ | |
| C. | 向Ba(OH)2溶液中逐滴加入硫酸氢钠溶液至中性:2H++SO2-4+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 硫化亚铁中加入稀硝酸:FeS+2H+═Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
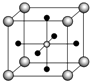 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.
金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com