

分析 (1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,根据构造原理书写Fe核外价电子排布式;
(2)根据Fe2+的核外电子排布式确定未成对电子数;
(3)原子的得电子能力越强,其电负性的数值越大;
(4)根据价层电子对互斥理论确定杂化类型,价层电子对个数=σ键个数+孤电子对,然后判断分子或离子的空间构型,再判断键角;
(5)根据价层电子对互斥理论确定杂化类型,价层电子对个数=σ键个数+孤电子对;
(6)氢键是一种特殊的分子间作用力,影响物质的物理性质熔点沸点;
(7)根据ρ=$\frac{m}{V}$计算.
解答 解:(1)铁是26号元素,其原子核外有26个电子,Fe原子的3d、4s电子为其价电子,根据构造原理书写Fe核外价电子排布式为3d64s2,
故答案为:3d64s2;
(2)Fe2+核外电子排布式为1s22s22p63s23p63d6,在3d上存在4个未成对电子,
故答案为:4;
(3)元素原子的得电子能力越强,则电负性越大,同周期从左到右元素的电负性逐渐增强,所以电负性:O>N>C,
故答案为:O>N>C;
(4)CH4分子中每个碳原子杂化轨道数为4,所以采取sp3杂化,为正四面体,键角为109°28′;
NH3分子中每个氮原子杂化轨道数为4,所以采取sp3杂化,三角锥形,键角为107°18′;
H2O分子中每个氧原子杂化轨道数为4,所以采取sp3杂化,为V形,键角为104.5°;
所以CH4、NH3、H2O的键角由小到大的顺序是:H2O<NH3<CH4,
故答案为:H2O<NH3<CH4;
(5)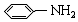 中碳原子杂化轨道数为3,所以采取sp2杂化,N元素全部形成单键,属于sp3杂化,
中碳原子杂化轨道数为3,所以采取sp2杂化,N元素全部形成单键,属于sp3杂化,
故答案为:sp2杂化;sp3杂化;
(6)氢键比范德华力强,是一种介于化学键与分子间作用力之间的作用力,含F、O、N元素的物质中分子内或分子之间能形成氢键,苯胺在水中与水形成氢键,而硝基苯与水不能形成氢键,所以苯胺在水中的溶解度远大于硝基苯的在水中的溶解度,
故答案为:苯胺与水形成氢键,而硝基苯与水不能形成氢键;
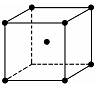
(7)Fe晶胞图为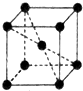 ,单质晶体为体心立方密堆积,晶体中Fe原子的配位数为8,其Fe的原子半径为apm=10-10acm,设晶胞棱长为xcm,则3x2=(4×10-10a)2,故x=$\frac{4\sqrt{3}}{3}a$×10-10cm,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,晶胞质量为$\frac{2×56}{{N}_{A}}$g,
,单质晶体为体心立方密堆积,晶体中Fe原子的配位数为8,其Fe的原子半径为apm=10-10acm,设晶胞棱长为xcm,则3x2=(4×10-10a)2,故x=$\frac{4\sqrt{3}}{3}a$×10-10cm,晶胞中Fe原子数目为1+8×$\frac{1}{8}$=2,晶胞质量为$\frac{2×56}{{N}_{A}}$g,
则晶体密度为:$\frac{2×56}{{N}_{A}}$g÷($\frac{4\sqrt{3}}{3}$a×10-10cm)3=$\frac{21\sqrt{3}}{4{a}^{3}{N}_{A}×1{0}^{-21}}$g/cm3,
故答案为:$\frac{21\sqrt{3}}{4{a}^{3}{N}_{A}×1{0}^{-21}}$.
点评 本题综合考查物质结构有关知识,涉及核外电子排布、键角大小比较、氢键、晶胞计算等,题目难度中等.晶胞计算是解答难点.


科目:高中化学 来源: 题型:选择题
| A. | 36 | B. | 24 | C. | 20 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向氯化铝溶液中加入过量氨水:AL3++3NH3•H2O=A1(OH)3↓+3NH4+ | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+=CO2+H2O | |
| C. | 铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 化亚铁溶液中通人少量氯气:Cl2+2Fe2+=2Fe3++2CL- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯化镁溶液加热蒸干:MgCl2+6H2O$\frac{\underline{\;\;△\;\;}}{\;}$ MgCl2•6H2O | |
| B. | 碘水中通适量SO2:I2+SO2+H2O═4H++2I-+SO42- | |
| C. | 氯化铝溶液加入足量氨水:A13++4NH3•H2O=A1O2-+4NH4++2H2O | |
| D. | 氯化铁溶液滴加少量氢硫酸:2Fe3++H2S=2Fe2++S↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 | |
| B. | 根据溶液的pH与溶液酸碱性的关系,推出pH=7.0的溶液一定显中性 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HC1、HBr、HI的还原性依次增强 | |
| D. | 结构和组成相似的物质,沸点随相对分子质量增大而升高,因此NH3沸点低于PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60s内反应速率为v(X)=0.05mol/(L•s) | |
| B. | 其它条件不变,升高温度,正反应速率增大,逆反应速率减小 | |
| C. | 其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | |
| D. | 其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3可用于治疗胃酸过多 | B. | 水玻璃浸泡过的木材能防腐 | ||
| C. | 明矾用于饮用水消毒 | D. | 晶体硅用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知:2NO2(g)?N2O4(g)△H=-52.7kJ/mol,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com