
【题目】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的三位同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
探究一
实验方案:铝镁合金![]() 测定剩余固体质量。实验中发生反应的化学方程式是_______________________________________。
测定剩余固体质量。实验中发生反应的化学方程式是_______________________________________。
实验步骤:
(1)称取5.4 g铝镁合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥________。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”或“偏低”)。
探究二
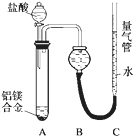
实验方案:铝镁合金![]() 测定生成气体的体积(实验装置如图所示,),问题讨论:
测定生成气体的体积(实验装置如图所示,),问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是________(填“需要”或“不需要”)。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):
①______________________________________,
②______________________________________。
探究三
实验方案:称量x g铝镁合金粉末,放在装有足量氧气的容器中惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是__________________。
(2)若用空气代替O2进行实验,对测定结果是否有影响?________(填“是”或“否”)。
【答案】2H2O+2Al+2NaOH==2NaAlO2+3H2 ↑ V≥97ml 偏大 不需要 冷却至室温再读数 读数时,使量气管左右液面相齐平 充分灼烧后固体粉末的质量 是
【解析】
探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除酸雾装置;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
探究三:(1)Mg、Al都能够与氧气发生反应生成氧化物;
(2)用空气代替O2进行实验,发生反应:3Mg+N2![]() Mg3N2,2Mg+CO2
Mg3N2,2Mg+CO2![]() 2MgO+C,测定生成固体的质量变大。
2MgO+C,测定生成固体的质量变大。
探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为: 2H2O+2Al+2NaOH==2NaAlO2+3H2 ↑;
因此,本题正确答案是:2H2O+2Al+2NaOH==2NaAlO2+3H2 ↑。
(1)含镁为3%时,金属铝的含量最高,5.4 g铝镁合金粉末样品中铝的质量为:5.4×(1-3%)=5.4×97%g;根据2H2O+2Al+2NaOH==2NaAlO2+3H2反应可知,2Al----2NaOH,所以54/2=5.4×97%/n(NaOH),n(NaOH)=0.194mol,需要NaOH溶液的体积V=0.194 mol/2.0 mol/L=0.097L=97mL;为保证合金充分反应,NaOH溶液的体积V≥97mL;
综上所述,本题答案是:V≥97mL。
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏大;
因此,本题正确答案是:偏大。
探究二:(1)因为氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除酸雾装置;
因此,本题正确答案是:不需要。
(2)反应中装置的气密性、合金是否完全溶解、量气装置的使用都会影响测定结果;因此为使测定结果尽可能精确,实验中应注意的问题是:检查装置的气密性,合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案);
综上所述,本题答案是:冷却至室温再读数;读数时,使量气管左右液面相齐平。
探究三(1) Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,才能计算出Mg的质量分数;
综上所述,本题答案是:充分灼烧后固体粉末的质量。
(2)若用空气代替O2进行实验,发生反应:3Mg+N2![]() Mg3N2,2Mg+CO2
Mg3N2,2Mg+CO2![]() 2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高;所以若用空气代替O2进行实验,对测定结果是有影响;
2MgO+C,测定生成固体的质量变大,则镁的质量分数偏高;所以若用空气代替O2进行实验,对测定结果是有影响;
综上所述,本题答案是:是。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】研究小组进行如下表所示的原电池实验:
实验编号 | ① | ② |
实验装置 |
|
|
实验现象 | 连接装置5 分钟后,灵敏电流计指针向左偏转,两侧铜片表面均无明显现象 | 左侧铁片表面持续产生气泡,连接装置5 分钟后,灵敏电流计指针向右偏转,右侧铁片表面无明显现象 |
下列关于该实验的叙述中,正确的是
A. 两装置的盐桥中,阳离子均向右侧移动
B. 实验①中,左侧的铜被腐蚀
C. 实验②中,左侧电极的电极反应式为2H++ 2e-=H2↑
D. 实验① 和实验②中,均有O2 得电子的反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如下图所示。反应中镁和铝的( )
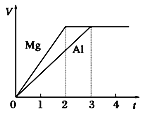
A. 物质的量之比为3∶2 B. 质量之比为3∶2
C. 摩尔质量之比为2∶3 D. 失去的电子数之比为8∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝粉与某些金属氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应.如:2Al+Fe2O3![]() 2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
2Fe+Al2O3,反应发生时放出大量的热.仔细阅读上述信息回答下列问题:
(1)“铝热反应”属于四大基本反应类型中的________反应.
(2)信息中的“某些”反应指________(填“比铝活泼的”、“比铝稳定的”或“任意”)金属.
(3)试写出铝粉与MnO2发生的铝热反应方程式________________________________.
(4)题给的铝热反应可用于野外焊接钢轨,试说明其原因:_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
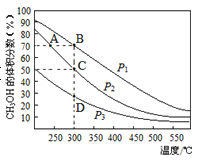
A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
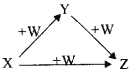
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种高效水处理剂,实验室通过以下反应制得ClO2: 2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
2ClO2↑+K2SO4+2CO2↑+2H2O,关于此反应的说法正确的是
A. KClO3发生化合价降低,失电子
B. 反应中H2SO4体现了酸性和强氧化性
C. 反应中H2C2O4被氧化
D. 产物中Cl与C化合价相同,因而氧化性一样强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com