
分析 碳酸钠属于强碱弱酸盐,碳酸根离子水解而使溶液呈碱性,根据其水解程度确定溶液pH,用pH试纸测量其pH即可.
解答 解:常温下,0.1mol•L-1的纯碱溶液,发生水解的CO32-离子不超过其总量的10%,则溶液中c(OH-)>0.1mol/L×10%=0.01mol/L,则c(H+)<$\frac{1{0}^{-14}}{0.01}$mol/L=10-12mol/L,所以溶液的pH<12,故操作方法为:用pH试纸测量常温下0.1mol/L碳酸钠溶液的pH,如果溶液的pH<12,则证明发生水解的CO32-离子不超过其总量的10%,
故答案为:用pH试纸(或pH计)测常温下0.1mol•L-1 Na2CO3溶液的pH,若pH<12就可 以说明Na2CO3溶液中水解的CO32-不超过其总量的10%.
点评 考查溶液pH的计算,充分考查学生灵活应用基础知识的能力,注意掌握酸碱混合的定性及溶液pH的计算方法判断方法,明确离子浓度定性比较的常用方法.


科目:高中化学 来源: 题型:选择题
| A. | 质量:④<①<③<② | B. | 密度:①<④<③<② | ||
| C. | 体积:④<①<②<③ | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列有关如图所示装置的叙述中错误的是( )
下列有关如图所示装置的叙述中错误的是( )| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加足量的NaOH溶液后,过滤洗涤灼烧,最终固体为72g | |
| B. | 加入过量稀硫酸,产生的气体遇空气能变成红棕色 | |
| C. | 加人过量的稀硫酸和KSCN溶液,溶液显血红色 | |
| D. | 该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
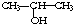 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2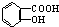 与适量NaHCO3溶液反应制备
与适量NaHCO3溶液反应制备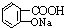
| A. | 只有①③④ | B. | 只有①④ | C. | 只有① | D. | 都不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1648.7 kJ.mo1-1 | B. | -1255.3 kJ.mol-1 | ||
| C. | -861.7 kJ.mol-l | D. | +867.1 kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取0.5L溶液,Na+的浓度是0.5mol/L | |
| B. | 取0.1L溶液稀释至l L,SO42-离子浓度是0.05 mol/L | |
| C. | 溶质的离子总数是6.02×1023个 | |
| D. | 该溶液是把0.5molNa2SO4溶于1L水中配制而成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com