
| A. | 3.36 L | B. | 4.48 L | C. | 5.6 L | D. | 6.72 L |
分析 混合溶液中发生的反应为AgNO3+KCl=AgCl+KNO3,根据方程式知,0.2molAgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合后溶液中的溶质为0.2mol KNO3、0.4mol Cu(NO3)2、0.4mol KCl,用惰性电极电解一段时间后,若在一极析出Cu0.3mol<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)=$\frac{0.2mol}{4}$=0.05mol,生成n(Cl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,再根据V=nVm计算气体体积.
解答 解:混合溶液中发生的反应为AgNO3+KCl=AgCl+KNO3,根据方程式知,0.2molAgNO3完全反应需要0.2molKCl,还剩余0.4molKCl,且同时生成0.2molKNO3,所以混合后溶液中的溶质为0.2mol KNO3、0.4mol Cu(NO3)2、0.4mol KCl,用惰性电极电解一段时间后,若在一极析出Cu0.3mol<0.4mol,根据Cu和转移电子之间的关系式知,转移电子的物质的量=2n(Cu)=2×0.3mol=0.6mol,氯离子完全放电时转移电子物质的量=0.4mol×1=0.4mol,则还有0.2mol电子转移时生成氧气,则生成n(O2)=$\frac{0.2mol}{4}$=0.05mol,生成n(Cl2)=$\frac{1}{2}$n(Cl-)=$\frac{1}{2}$×0.4mol=0.2mol,生成气体V=nVm=(0.2+0.05)mol×22.4L/mol=5.6L,
故选C.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断及计算能力,明确离子共存条件、电解时溶液中溶质成分及其物质的量是解本题关键,注意氯离子和银离子的反应,为易错题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
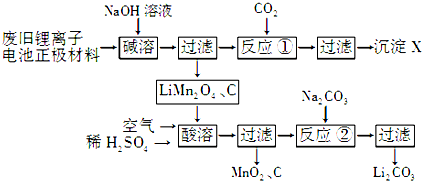
| T/℃ | w(Mn2+)(%) | w(Mn3+)(%) | w(Mn4+)(%) |
| 700 | 5.56 | 44.58 | 49.86 |
| 750 | 2.56 | 44.87 | 52.57 |
| 800 | 5.50 | 44.17 | 50.33 |
| 850 | 6.22 | 44.40 | 49.38 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
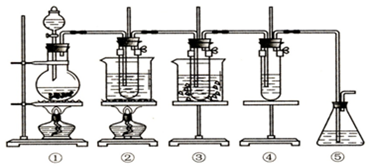
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
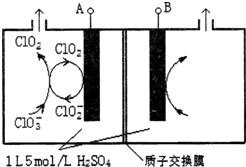 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积:④<①<③<② | B. | 质量:④<①<③<② | ||
| C. | 物质的量:①<②<③<④ | D. | 氢原子数:②<④<③<① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com