
| A. | 1 g Na2CO3 | B. | 0.1mol CaCO3 | C. | 56 g Fe | D. | 10 mLH2O |
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、Mg2+ | B. | Mg2+、Fe2+ | C. | NH4+、Fe2+ | D. | Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
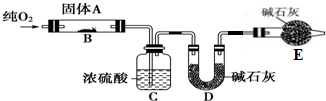
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
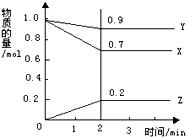 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com