
瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如图所示,下列有关说法正确的是
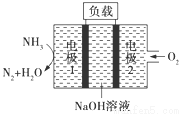
A.电池工作时,Na+向电极1移动
B.电池工作一段时间后停止,溶液pH值不变
C.电极1发生的电极反应为2NH3+6OH--6e-===N2↑+6H2O
D.用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3 的同时阳极会得到19.2g纯铜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届青海省高三下高考冲刺一理综化学试卷(解析版) 题型:实验题
阿司匹林口服时,具有解热镇痛作用。是一种常用的治疗感冒的药物,也可用于抗风湿,促进痛风患者尿酸的排泄。近年来还发现阿司匹林能抑制血小板凝聚,可防止血栓的生成。它的有效成分是乙酰水杨酸( )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐【(CH3CO)2O】为主要原料合成乙酰水杨酸。
【反应原理及部分装置】
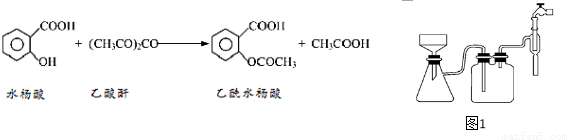
【实验流程】
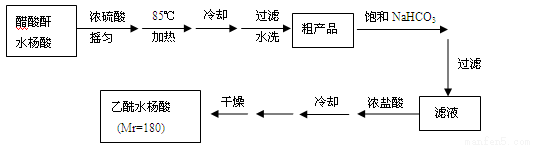
已知:①醋酸酐遇水分解生成醋酸。
②水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,副产物为高分子化合物,难溶于水。
回答下列问题:
(1)合成过程中要控制温度在85℃~90℃,最合适的加热方法 。
(2)用图1装置过滤比普通漏斗过滤的优点是 。
(3)粗产品提纯:
①分批用少量饱和NaHCO3溶液溶解粗产品,目的是 ;判断该过程结束的现象是 。
②加浓盐酸、冷却后的操作是__________、______、干燥、称重、计算产率。
③纯度检验:取少许产品加入盛有2 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色。可能的原因是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品mg;
Ⅱ.将样品研碎,溶于V1 mL a mol/LNaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;
Ⅲ.向锥形瓶中滴加几滴甲基橙,用浓度为b mol/L的标准盐酸滴定剩余的NaOH,消耗盐酸的体积为V2 mL。
已知:乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式:
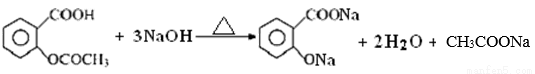
则阿司匹林药片中乙酰水杨酸质量分数的表达式为:____________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:实验题
中学常采用高锰酸钾加热分解法制取氧气,某兴趣小组经查阅资料获知:制得氧气后固体残余物中的锰酸钾(K2MnO4)具有强氧化性,与还原剂、有机物、易燃物混合可形成爆炸性混合物,如不妥善处置将造成危险。因此该小组对该残余物进行分离提纯,得到锰酸钾晶体,利用回收的锰酸钾与浓盐酸反应制取氯气,并设计实验验证氯气化学性质。
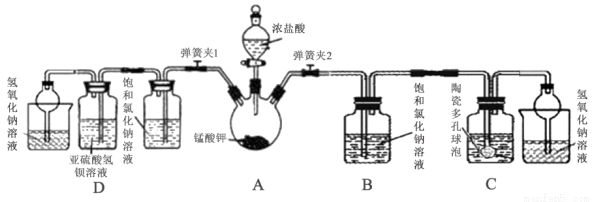
(1)打开分液漏斗活塞及弹簧夹2,观察到烧瓶壁有紫红色物质生成并逐渐消失,黄绿色气体充满烧瓶。反应结束后,烧瓶内有黑色固体残余,写出过程中发生的化学反应方程式:____________。
(2)该方法制取氯气比用纯净的高锰酸钾要缓和平稳许多,试分析原因____________。
(3)该小组利用装置C吸收氯气制备漂白粉。
①C中盛装的试剂为____________;
②陶瓷多孔球泡的作用是____________。
(4)测定漂白粉有效成分的质量分数:称取1.5g所制漂白粉配成溶液,调节pH值并加入指示剂,用0.1000mol/L KI溶液进行滴定,三次平行实验平均每次消耗20.00mL标准液时达到滴定终点,反应原理涉及到的方程式为:3ClO-+I-=3Cl-+ IO3- ; IO3-+5I-+3H2O=6OH-+3I2
①所选的指示剂为____________,达到滴定终点的标志是____________。
②该漂白粉中有效成分的质量分数为____________。
(5)打开分液漏斗活塞及弹簧夹1,可观察到D中的现象为____________ ,该现象能够证明氯气有氧化性。甲同学认为取D中反应后溶液,滴加硝酸酸化的硝酸银,若有白色沉淀产生,也能证明氯气氧化了亚硫酸氢钡,你认为是否正确并说明理由____________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:选择题
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A、HN3与NH3作用生成的叠氮酸铵是共价化合物
B、HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3?)>c(OH?)
C、NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3?) >c(OH?)>c(H+)
D、N3?与CO2含相等电子数
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:简答题
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
I (1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式________________________。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=_____(用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag++□______=□PO43-+□Ag+□______
(3) 工业上生产硝酸铜晶体的流程图如下:
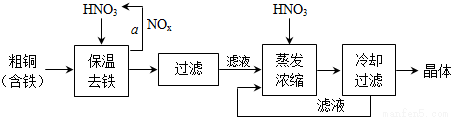
①在步骤a中,需要通入氧气和水,其目的是______.
②进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)______.
③下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是______(填字母).
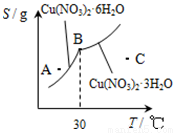
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2•3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体
II (4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:计算题
把3molA和2.5molB混合与2L密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),5min后达平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min)。求:
(1)x= 。
(2)平衡时C的浓度为多少?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
元素M的最高正价和负价的绝对值之差为6,M、N的离子具有相同的电子排布,则M、N所形成的化合物可能是( )
A.MgF2 B.MgCl2 C.CaCl2 D.CaBr2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
关于如图所示装置的叙述,正确的是( )

A.锌是正极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高二下期中化学试卷(解析版) 题型:实验题
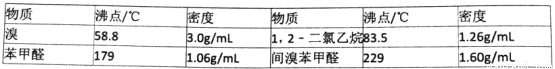
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的沸点见附表)。其实验步骤为:
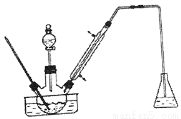
步骤1:将三颈瓶中的一定配比的无水AlCl3, 20mLl, 2 -二氯乙烷和20mL苯甲醛充分混合后.升温至60℃,缓慢滴加经H2SO4干燥过的液溴20mL,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,__________。
步骤3:有机相用10%NaHCO3溶液洗涤。经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是__________,锥形瓶中的溶液应为__________。
(2)步骤1所加入的物质中,AlCl3是催化剂,请推测1, 2-二氯乙烷的作用__________。
(3)有同学建议将装置中温度计换成搅拌器,那么温度计应移到什么地方__________。
(4)步骤2后续操作是__________。
(5)步骤3中用10%的NaHCO3溶液洗涤的具体操作是__________。加入无水MgSO4固体的作用是__________。
(6)步骤4中采用减压蒸馏技术,是为了防止__________。
(7)最后收集到间溴苯甲醛10mL,则该实验的产率为__________。
附表相关物质的沸点(101kPa)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com