
将氧化还原反应2H2+O2===2H2O设计成原电池。
(1)利用氢气和氧气、氢氧化钾溶液构成燃料电池,则负极通入的气体应是________,正极通入的气体是________,电极反应为:正极__________________,负极______________________。
(2)若把KOH溶液改为稀硫酸做电解质溶液,则电极反应为:正极________,负极________________。
(3)若把H2改为CH3OH,KOH溶液做电解质溶液,则电极反应为:正极_____________________________________________,
负极__________。电池反应为____________。
解析 (1)由电池反应可知在反应中H2被氧化,O2被还原。H2应该在负极上反应,O2应该在正极上反应,又因为是碱溶液,不可能有H+参加或生成,故负极的电极反应为2H2+4OH--4e-===4H2O,正极的电极反应为O2+2H2O+4e-===4OH-。
(2)若将电解质溶液换为酸溶液,此时应考虑不可能有OH-生成,故负极的电极反应为2H2-4e-===4H+,正极的电极反应为O2+4H++4e-===2H2O。
(3)如把H2改为CH3OH,KOH溶液做电解质溶液,则正极反应为3O2+6H2O+12e-===12OH-,负极反应为2CH3OH+16OH--12e-===2CO +12H2O。正、负极反应相加得电池反应:2CH3OH+3O2+4KOH===2K2CO3+6H2O。
+12H2O。正、负极反应相加得电池反应:2CH3OH+3O2+4KOH===2K2CO3+6H2O。
答案 (1)H2 O2 O2+2H2O+4e-===4OH- 2H2+4OH--4e-===4H2O
(2)O2+4H++4e-===2H2O 2H2-4e-===4H+
(3)3O2+6H2O+12e-===12OH-
2CH3OH+16OH--12e-===2CO +12H2O
+12H2O


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
已知:2KMnO4+16HCl=2KCl+5Cl2↑+2MnCl2+8H2O
对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>Cl- |

查看答案和解析>>
科目:高中化学 来源: 题型:
CH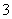 、—CH3、CH
、—CH3、CH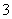 都是重要的有机反应中间体,有关它们的说法正确的是 ( )。
都是重要的有机反应中间体,有关它们的说法正确的是 ( )。
A.它们互为等电子体,碳原子均采取sp2杂化
B.CH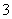 与 NH3、H3O+ 互为等电子体,立体构型均为正四面体形
与 NH3、H3O+ 互为等电子体,立体构型均为正四面体形
C.CH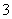 中的碳原子采取 sp2 杂化,所有原子均共面
中的碳原子采取 sp2 杂化,所有原子均共面
D.CH 与OH- 形成的化合物中含有离子键
与OH- 形成的化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
《物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律;以微粒之间不同的作用力为线索,研究不同类型物质的有关性质;从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是________(填序号)。
A.元素电负性由大到小的顺序为:F>O>N
B.一个苯分子含3个π键和6个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为:Br>Se>As

(2)根据等电子体原理,羰基硫(OCS)分子的结构式应为________。光气(COCl2)分子内各原子最外层都满足8电子稳定结构,则光气分子的立体构型为________(用文字描述)。
(3)Cu2+基态的电子排布式为____________________________________。
向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,该物质中配位原子的杂化方式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
近来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全。电池总反应式为C2H5OH+3O2===2CO2+3H2O,下列说法不正确的是( )
A.C2H5OH在电池的负极上参加反应
B.1 mol乙醇被氧化转移6 mol电子
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应为 4H++O2+4e-===2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com