
| 加入物质 | 电离平衡移动方向 | 溶液中[H+]的变化 |
| 少量固体NaOH | ||
| 固体CH3COONa | ||
| 同浓度的醋酸 | ||
| 少量硫酸溶液 |
| 加入物质 | 电离平衡移动方向 | 溶液中[H+]的变化 |
| 少量固体NaOH | 向右 | 减小 |
| 固体CH3COONa | 向左 | 减小 |
| 同浓度的醋酸 | 不移动 | 不变化 |
| 少量硫酸溶液 | 向左 | 增大 |
| 加入物质 | 电离平衡移动方向 | 溶液中[H+]的变化 |
| 少量固体NaOH | 向右 | 减小 |
| 固体CH3COONa | 向左 | 减小 |
| 同浓度的醋酸 | 不移动 | 不变化 |
| 少量硫酸溶液 | 向左 | 增大 |


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
| A、制取漂白粉和用烧碱溶液吸收氯气 |
| B、浓硫酸和浓硝酸长期暴露在空气中浓度降低 |
| C、SO2能使酸性KMnO4和滴有酚酞的NaOH溶液褪色 |
| D、氯水和SO2可使品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
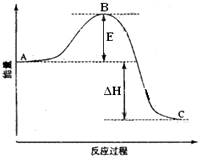 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
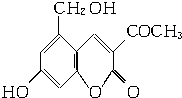 2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式如图,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭.“亮菌甲素”的结构简式如图,它配以辅料丙二醇溶成针剂用于临床.假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
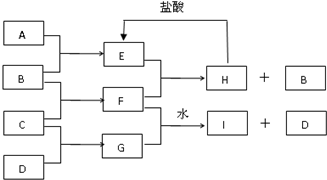 A、B、C、D是按原子序数由小到大排列的第二、第三周期元素的单质.B、E均为组成空气的成分.D为淡黄色固体.F的焰色反应呈黄色.一定条件下,各物质之间的相互关系如图所示(图中部分产物没有列出).
A、B、C、D是按原子序数由小到大排列的第二、第三周期元素的单质.B、E均为组成空气的成分.D为淡黄色固体.F的焰色反应呈黄色.一定条件下,各物质之间的相互关系如图所示(图中部分产物没有列出).查看答案和解析>>
科目:高中化学 来源: 题型:
| ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 第4周期 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W、X、Y、Z的原子半径大小顺序可能是:W>X>Y>Z |
| B、WY2分子中δ键与π键的数目之比是1:1 |
| C、Y、Z形成的分子空间构型可能是直线形 |
| D、W、Y、Z的电负性大小顺序一定是Z>Y>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com