
����Ŀ��20��ʱ����20 mL 0.1 mol��L-1��Na2CO3��Һ����μ���0.1 mol��L-1����������H2CO3�ķֽ��CO2�Ļӷ�������ҺpH���������������仯������ͼ������˵����ȷ����

A. �����ʾ��Һ�У�c(CO32��)��c(HCO3��)��c(OH��)��c(H+)
B. �����ʾ��Һ�У�c(CO32��)��c(Cl��)��c(HCO3��)��c(OH��)
C. �����ʾ��Һ�У�c(OH��)��c(H+)��c(H2CO3)��c(CO32��)
D. �����ʾ��Һ�У�c(Cl��)��2c(H2CO3) + c(HCO3��)
���𰸡�CD
�������������̼������Һ��c(CO32��)��c(OH��) ��c(HCO3��)��c(H+)����A�����������20 mL 0.1 mol��L-1��Na2CO3��Һ����μ���10 mL 0.1 mol��L-1���ᣬ��һ���̼��������̼�����ƣ�̼�������ˮ��̶ȴ���̼��������ӣ�����c(HCO3��) ��c(Cl��)��c(CO32��)��c(OH��)����B�����ΪNa2CO3��Һ������ǡ�÷�Ӧ����̼�����ƣ����������غ�c(OH��)��c(H+)��c(H2CO3)��c(CO32��)����C��ȷ�����Ϊ���ԣ����ݵ���غ�c(HCO3��)+2c(CO32��)+c(Cl��)��c(Na+) �����������غ�c(Na+)= 2c(HCO3��)+2c(CO32��)+ 2c(H2CO3)������c(Cl��)��2c(H2CO3) + c(HCO3��)����D��ȷ��


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3��4��5-������������ȩ���Ʊ�������Ч��TMP���м��壬ͨ������ͨ������;���ϳɡ�
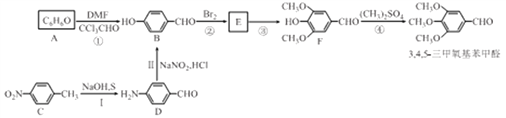
(1)д��C������: __________������˵������ȷ����______________(��ѡ����ĸ)��
A.��Ӧ��Ҫ����������ֹ��CHO������
B.1 mol�л���F�������3 mol H2�����ӳɷ�Ӧ
C.�л���D����ʹKMnO4��Һ��ɫ
D.��I�����漰�ķ�Ӧ������������Ӧ����ԭ��Ӧ
(2)�л���E�Ľṹ��ʽΪ____________��E��F�ķ�Ӧ����Ϊ___________��Ӧ��
(3)D������Cu(OH)2��Ӧ�Ļ�ѧ����ʽΪ__________________��
(4)��������������C��ͬ���칹����__________�֣�д������һ�ֵĽṹ��ʽ��_____________��
�ٺ���������������к��б�����![]() �ṹ
�ṹ
��H��NMR����ʾ�����������ֲ�ͬ��ѧ��������
(5)��֪��RCHO+CH3COOR'![]() RCH�TCHCOOR'�����������Ϣ������Ա��Ӻ���������Ϊԭ�ϣ������Լ���ѡ���Ʊ�
RCH�TCHCOOR'�����������Ϣ������Ա��Ӻ���������Ϊԭ�ϣ������Լ���ѡ���Ʊ�![]() �ĺϳ�·�ߣ�__________��
�ĺϳ�·�ߣ�__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�뽺�������ص���
A. �ڶ����������±������
B. �����뺣�����γ�ɳ��
C. ���Ȼ�����Һ�е�������������Һ���ֺ��ɫ����
D. һ���������䵰������Һʱ���Ӳ���ɿ���������ͨ·
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʹ0.1mol/L��NaHCO3��Һ��c(H+)��c(CO32-)��c(HCO3-)�����٣��� ��
A. ͨ�������̼���� B. �����������ƹ���
C. ͨ���Ȼ������� D. ���뱥��ʯ��ˮ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ȼ�ϵ�ؿ�������ˮ��������ˮ�������乤��ԭ����ͼ��ʾ������˵����ȷ����

A. �õ�����ڸ����¹���
B. �õ�ع���ʱ���м����е�Cl����������
C. �����Ϸ����ĵ缫��Ӧ��2NO3��+ 6H2O + 10e���T N2 ��+ 12OH��
D. ���л���ˮ���л�����C6H12O6��ʾ��ÿ����1 mol C6H12O6 ת��4 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ߵ�ֱ��Ӱ��������������������Խ��Խ�ܵ����ǵĹ�ע������Ⱦ�Ŀ��������ʵijɷ��ж��֣�����CO���Ǽ��롶���������ձ���������Ⱦָ������Ŀ֮һ���ҹ����л����еĴ�����Ⱦ����Ҫ��
A. CO2��Cl2��N2��SO2 B. SO2��NO2�������������
C. NH3��CO2��NO2���� D. HCl��SO2��N2�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ƣ�Na2S2O5���dz��õ�ʳƷ��������֮һ��
��1��ʵ������40�桢pH��4����������Na2SO3��Һ��SO2��Ӧ��ȡNa2S2O5��Na2SO3+SO2��Na2S2O5ʵ��ʱ����CO2���御�����ų�װ���ڿ�����Ŀ����_____________��
��2�����Ʊ�19 g Na2S2O5�������״����SO2_____________L��
��3��Ϊ�˼���ij����������Ʒ��Na2S2O5������������ij�о�С���������ʵ�飺
����I����ȡ����������Ʒ0.2 g��������뵽��I2Ũ��Ϊ0.05000 mol��L1 ��100 mLϡ����͵�ˮ�Ļ����Һ�У�Ȼ���ˮϡ����500 mL��
����II��ȡϡ�ͺ����Һ100 mL�����뼸�ε�����Һ����0.1000 mol��L1 Na2S2O3����Һ���еζ���������Na2S2O3����Һ12.00 mL��2S2O32�� + I2��2I�� + S4O62������
��д������I��Na2S2O5��I2��Ӧ�����ӷ���ʽ_____________��
�ڼ��㿹��������Ʒ��Na2S2O5����������д���������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵����ȷ����( )
A. ����FeI2����Һ��ͨ����������������1molFe2+������ʱ���÷�Ӧת�Ƶ�����ĿΪ3NA
B. 40gCuO��Cu2S�����������ͭԭ�ӵ���Ŀ������0.5 NA
C. ��0.1molNH4HSO4����Һ�У���������Ŀ��С��0.2NA
D. C3H8�����е�2��Hԭ�ӷֱ�1����NH2��1����OHȡ����1mol���л����������õ��Ӷ���ĿΪ13NA
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com