
分析 (1)用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比;PH试纸已经用蒸馏水湿润,稀释了待测溶液;
(2)溶液呈中性,根据电荷守恒列关系式:c(Al3+)×3+c(K+)=2×c(SO42-),将各种离子浓度代入即可.
解答 解:(1)用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比;溶液为碱性,经蒸馏水稀释后,所测pH要减小,故答案为:将pH试纸置于干燥、洁净的玻璃片或瓷板上,用洁净的玻璃棒蘸取待测液,滴在pH试纸的中央,片刻后,与标准比色卡对照,读取pH值;偏小;
(2)溶液呈中性,根据电荷守恒列关系式:c(Al3+)×3+c(K+)=2×c(SO42-),将各种离子浓度代入得:c(Al3+)×3+0.2mol•L-1=2×0.7mol•L-1,c(Al3+)=0.4mol/L;
故答案为:0.4mol/L.
点评 本题考查了pH试纸的使用方法和电解质物质的量浓度的相关计算,掌握公式的运用是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaCl NaBr | B. | NaCl NaBr Na2SO4 | ||
| C. | NaCl | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH4+的空间构型是正四面体.
;NH4+的空间构型是正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④⑤⑥⑦ | C. | ②④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜锌组成的原电池中电子是从锌经过导线流向铜 | |
| B. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡 | |
| C. | 把铜片插入FeCl3溶液中,在铜片表面出现一层铁 | |
| D. | 把锌片放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ksp(AgI)>Ksp(AgCl) | |
| B. | 加过量KI溶液充分反应后,溶液中Ag+和I-的浓度之积大于Ksp(AgI) | |
| C. | 加过量KI溶液充分反应后,溶液中Ag+和Cl-的浓度之积大于Ksp(AgCl) | |
| D. | 以上结论都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | YM2、Y2X2、W2M2均为直线型的共价化合物 | |
| C. | 元素Z和元素M的最高正价的数值之和等于11 | |
| D. | 由X、Y、Z、M四种元素形成的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐溶液一定呈中性 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
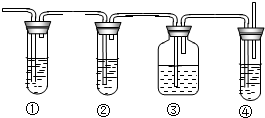 实验室里用乙醇和浓硫酸来制取乙烯:
实验室里用乙醇和浓硫酸来制取乙烯:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com