
分析 (1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)2.33g沉淀为硫酸钡,根据n=$\frac{m}{M}$计算出硫酸钡的物质的量,再根据n=$\frac{n}{V}$计算出硫酸根离子的浓度;
(3)铁与硫酸、硫酸铜的反应中物质的量关系都是1:1,则硫酸根离子的物质的量即为铁的物质的量,结合(2)计算出铁的物质的量,再根据m=nM计算出其质量;
(4)根据铜的量计算出生成二氧化硫的物质的量,再结合反应生成亚硫酸钠、亚硫酸氢钠分别计算出a的值,从而得出其取值范围;
(5)铜与浓硫酸的反应中,浓硫酸变成稀硫酸,反应停止,所以参加反应的硫酸越大小于溶液中总的硫酸,据此进行分析.
解答 (1)Cu与足量的浓硫酸在加热条件下充分反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2+2H2O;
(2)2.33g硫酸钡的物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,则稀释后溶液中硫酸根离子的物质的量为0.01mol,其浓度为:$\frac{0.01mol}{0.05L}$=0.2mol/L,
故答案为:0.2 mol/L;
(3)根据(2)可知,稀释后溶液中硫酸根离子浓度为0.2mol/L,则硫酸根离子的总物质的量为:0.2mol/L×0.5L=0.1mol,
反应后溶液中含有硫酸铜和剩余的硫酸,根据反应关系式Fe~H2SO4、Fe~CuSO4可知,反应消耗铁的物质的量与硫酸根离子的物质的量相等,即为0.1mol,则需要铁的质量为:56g/mol×0.1mol=5.6g,
故答案为:5.6;
(4)3.2g铜的物质的量为:$\frac{3.2g}{64g/mol}$=0.05mol,根据反应方程式可知,0.05mol铜完全反应生成0.05mol二氧化硫,
100mL amol•L-1的NaOH溶液中含有氢氧化钠的物质的量为:amol/L×0.1L=0.1amol,
当氢氧化钠与二氧化硫反应生成亚硫酸钠时,消耗氢氧化钠的物质的量为:0.1amol=0.05mol×2,解得:a=1,
当二者反应生成亚硫酸氢钠时,消耗氢氧化钠的物质的量为:0.1amol=0.05mol,解得:a=0.5,
所以a的范围为:0.5≤a≤1,
故答案为:0.5≤a≤1;
(5)若浓硫酸中含溶质bmol,投入足量的铜片并加热,充分反应后,由于稀硫酸不与铜反应,则被还原的硫酸的物质的量一定小于0.5b,
故答案为:<.
点评 本题考查了范围讨论的计算、化学方程式的计算,题目难度中等,试题知识点较多、计算量较大,充分考查了学生的分析能力及化学计算能力,(4)需要明确反应产物,为易错点.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(X)/(mol/L) | 0.10 | 0.10 | 0.20 |
| c(Y)/(mol/L) | 0.15 | 0.18 | 0.30 |
| A. | 反应开始时,甲中反应速率最慢,丙中反应速率最快 | |
| B. | 反应达到平衡时,甲、丙中Q的体积分数相等 | |
| C. | 乙中反应达到平衡时,X的转化率大于60% | |
| D. | 甲中反应达到平衡时,c(Y)=0.10mol/L |
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
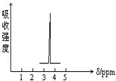 化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,预测B的核磁共振氢谱上有2个峰.
化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如图所示,则A的结构简式为:CH2BrCH2Br,预测B的核磁共振氢谱上有2个峰.查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32-
B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3-
D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
下列关于溶液和胶体的叙述,正确的是
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质分子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
D.一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com