
(14分)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.实验室利用下图A装置制备乙酸乙酯.
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:
与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是 .
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol?L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol?L-1H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |

(1)CH3COOH+CH3CH218OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
冷凝和防止倒吸;(2)① 3; 4 ;② AC ;
(3) 66.7% ;(4) ①饱和Na2CO3溶液;蒸馏; 蒸馏;D;②除去乙酸乙酯中混有的少量水(或干燥);(5)乙。
解析试题分析:(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:CH3COOH+ CH3CH218OH  CH3CO18OC2H5+H2O;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是冷凝和防止倒吸;(2)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.由于在实验C中使用的硫酸是3mL 2mol?L-1,为了使条件与C相同,所以在实验D中应加入一元强酸盐酸的体积和浓度分别是3mL和4mol?L-1。②分析实验A、C 可知:其它条件相同只有硫酸的浓度不同,结构使用浓硫酸反应产生的酯多,说明浓H2SO4的吸水性提高了乙酸乙酯的产率;(3)n(乙酸)=90g÷60g/mol=1.5mol,n(乙醇)=138g÷46g/mol=3mol,由于乙醇过量,所以应该按照乙酸来计算得到的酯的质量。n(乙酸乙酯)=88g÷88g/mol=1mol,则该反应的产率为_1mol÷1.5mol)×100%=66.7%。(4)①试剂a是饱和Na2CO3溶液,通过分液分离得到:A是乙酸乙酯;B是含有乙醇、乙酸钠、碳酸钠的溶液;向乙酸乙酯中加入碳酸钠固体除去其中少量的水,然后过滤得到纯净的乙酸乙酯;将B蒸馏可以得到E:乙醇;溶液是乙酸钠、碳酸钠的溶液;向其中加入浓硫酸,得到乙酸、硫酸钠的混合物,利用二者沸点的不同,通过蒸馏就可以得到乙酸。分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出,故选项是D.②在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水(或干燥);(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).由于甲中未发生反应的乙酸乙醇都随着产生的酯挥发出去,所以物质的利用率降低,而乙都回流到反应装置,从而利用率大大提高,所以我认为最合理的是乙。
CH3CO18OC2H5+H2O;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是冷凝和防止倒吸;(2)①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.由于在实验C中使用的硫酸是3mL 2mol?L-1,为了使条件与C相同,所以在实验D中应加入一元强酸盐酸的体积和浓度分别是3mL和4mol?L-1。②分析实验A、C 可知:其它条件相同只有硫酸的浓度不同,结构使用浓硫酸反应产生的酯多,说明浓H2SO4的吸水性提高了乙酸乙酯的产率;(3)n(乙酸)=90g÷60g/mol=1.5mol,n(乙醇)=138g÷46g/mol=3mol,由于乙醇过量,所以应该按照乙酸来计算得到的酯的质量。n(乙酸乙酯)=88g÷88g/mol=1mol,则该反应的产率为_1mol÷1.5mol)×100%=66.7%。(4)①试剂a是饱和Na2CO3溶液,通过分液分离得到:A是乙酸乙酯;B是含有乙醇、乙酸钠、碳酸钠的溶液;向乙酸乙酯中加入碳酸钠固体除去其中少量的水,然后过滤得到纯净的乙酸乙酯;将B蒸馏可以得到E:乙醇;溶液是乙酸钠、碳酸钠的溶液;向其中加入浓硫酸,得到乙酸、硫酸钠的混合物,利用二者沸点的不同,通过蒸馏就可以得到乙酸。分离方法①是分液,在具体操作中应充分振荡,然后静置,待分层后先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口放出,故选项是D.②在得到的A中加入无水碳酸钠粉末,振荡,目的是除去乙酸乙酯中混有的少量水(或干燥);(5)为充分利用反应物,甲、乙两位同学分别设计了上面图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).由于甲中未发生反应的乙酸乙醇都随着产生的酯挥发出去,所以物质的利用率降低,而乙都回流到反应装置,从而利用率大大提高,所以我认为最合理的是乙。
考点:考查实验室制取乙酸乙酯的反应原理、实验操作、混合物的分离、原料的利用率等知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:单选题
下列关于糖类、蛋白质、油脂和纤维素的说法中,正确的是
A.它们的组成中都有C、H、O、N等元素
B.在一定条件下,它们都能发生水解反应
C.它们都是高分子化合物
D.油脂都是高级脂肪酸的甘油酯,是一种高热量营养素
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是某有机物分子的简易球棍模型,该有机物中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是
A.易溶于乙醇,难溶于水
B.分子式为C3H7NO2
C.能和盐酸或NaOH溶液发生反应
D.能通过聚合反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
假如将我们面前的这张试卷揉成一团,浸入装有稀硫酸的烧杯中,经过充分反应后,烧杯中产生的新物质是什么?
| A.蔗糖 | B.葡萄糖 | C.果糖 | D.纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
药物贝诺酯可以水杨酸为原料在一定条件下反应制得,主要反应过程如下:
请回答下列问题:
(1)水杨酸的分子式为: ,它的含氧官能团分别名称为: 和 。
(2)1mol 水杨酸完全燃烧需要消耗 mol O2。
(3)水杨酸溶液中加入几滴FeCl3溶液,溶液显 色。
(4)反应①的反应类型为: ,请写出水杨酸与足量NaOH溶液反应的化学方程式: 。
(5)苯胺(C6H5—NH2)与乙酸酐在一定条件下发生类似①的反应,生成乙酰苯胺,试写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源。
(1)设汽油成分为C8H18,若在气缸中汽油高温裂解产生丁烷和丁烯,写出该反应的化学方程
。
(2)气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g) △H >0
2NO(g) △H >0
①汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因是 。
②1mol空气中含有0.8molN2和0.2molO2,1300℃时在含1mol空气的密闭容器内反应达到平衡。测得NO为8×10-4mol。计算该温度下的平衡常数K≈ 。
(3)尾气中的CO主要来自于汽油不完全燃烧。
①有人设想按下列反应除去CO:2CO(g)=2C(s)+O2(g) △H=+221kJ·mol-1, 简述该设想能否实现的依据: 。
②测量汽车尾气的浓度常用电化学气敏传感器,其中CO传感器可用下图简单表示,则阳极发生的电极反应为 。
(4)在汽车尾气系统中安装催化转换器,可有效减少尾气中的CO、NOx 和碳氢化合物等废气。
已知:N2(g)+O2(g)=2NO(g) △H1=+180kJ/mol
CO(g) +1/2O2(g)= CO2(g) △H2=-283kJ/mol
2NO(g)+ 2CO(g) = 2CO2(g) + N2(g) △H3
则△H3 = kJ·mol-1。
(5)光化学烟雾(含臭氧、醛类、过氧乙酰硝酸酯等)是汽车尾气在紫外线作用下发生光化学反应生成的二次污染物。写出2-丁烯与臭氧按物质的量之比为1:2反应生成乙醛及氧气的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(每空2分,共10分)近年,国际原油价格大幅上涨,促使各国政府加大生物能生产,其中酒精汽油已进入实用化阶段。
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):______________________________________。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为________________________________________。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是____________________________________。
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷( )该反应的原子利用率为100%,反应的化学方程式为___________。
)该反应的原子利用率为100%,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
I.乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的结构简式为____________。
(2)下列物质中,不可以通过乙烯加成反应得到的是______(填序号)。
| A.CH3CH3 | B.CH3CHCl2 |
| C.CH3CH2OH | D.CH3CH2Br |
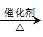 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)1 mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L(标准状况)氢气,则A分子中必有一个 基,若此基在碳链的一端,且A中无支链,则A的结构简式为 。
(2)A与浓硫酸共热,分子内脱去1分子水,生成B,B的结构简式为 ;B通入溴水中能发生 反应,生成C,C的结构简式为 。
(3)A在铜作催化剂时,与氧气在加热条件下发生氧化还原反应生成D,D的结构简式为 。
写出下列指定反应的化学方程式:
①A→B ;
②B→C ;
③A→D 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com