
| A. | 多糖水解可以生成乙醇,故可用玉米、秸秆等为原料制取乙醇 | |
| B. | 葡萄糖是醛糖,果糖是酮糖,但不能用银镜反应来区分葡萄糖和果糖 | |
| C. | 油脂在碱性条件下水解生成甘油和髙级脂肪酸,此反应又称皂化反应 | |
| D. | 鉴别蚕丝、纯神、涤纶可采用灼烧闻气味的方法,涤纶灼烧时有烧焦羽毛的气味 |
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③⑤ | C. | ①②③④ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数.B原子核内质子数和中子数相等.下列叙述不正确的是( )| A. | C元素是非金属性最强的元素 | |
| B. | A元素最高价氧化物对应的水化物具有强氧化性 | |
| C. | 三种元素的原子半径的大小顺序是:B>C>A | |
| D. | B元素的氧化物、氢化物的水溶液都呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 来表示,下列关于苯的叙述中正确的是( )
来表示,下列关于苯的叙述中正确的是( )| A. | 用溴水可以区分苯、四氯化碳、环己烯 | |
| B. | 苯中的化学键是介于单键与双键之间的化学键,不能发生加成反应 | |
| C. | 苯和溴水在三溴化铁做催化剂下发生取代反应,一定条件下能与氢气发生加成反应 | |
| D. | 苯与硝酸在浓硫酸催化下加热生成硝基苯,苯也能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题:
碳、镁、镍在工业生产和科研领域有广泛用途.请回答下列问题: )等.
)等. 是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.
是常用的分析试剂.其中位于同周期的三种基态原子第一电离能由小到大的顺序为C<O<N(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为OCN-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用布袋购物、以步代车属于“低碳生活”方式 | |
| B. | 饮用水中矿物质的含量越高越有利于人体健康 | |
| C. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 采用光触媒技术可将汽车尾气中的NO和CO转化为无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号溶液 | 1 | 2 | 3 | 4 |
| KMnO4(mL) | 20.01 | 19.00 | 19.99 | 20.00 |
| Na2SO3(mL) | 25.00 | 25.00 | 25.00 | 25.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
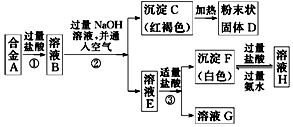 铁和铝是日常生活中用途广泛的金属.
铁和铝是日常生活中用途广泛的金属.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com