
| A. | Q与Y组成的常见物质是一种两性物质,结构中含有共价键 | |
| B. | 已知WRZQ3溶液呈酸性,若将WRZQ3固体溶于水,能促进水的电离 | |
| C. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 | |
| D. | 元素T、Q、W、Y的原子半径大小为T<Q<Y<W |
分析 短周期原子序数依次增大的主族元素R、T、Q、W、Y、Z,其中R、Y原子的最外层电子数与电子层数相同,符合条件的元素有H、Be、Al;Q是地壳中含量最高的元素,则Q为O元素;由于R与T的核电荷数之和等于Q的核电荷数,Al原子序数大于O,R为Be时,T的原子序数为4,R、T原子序数相同,则R只能为H元素,Y为Al,则T的原子序数=8-1=7,即T为N元素;W与R同主族,结合原子序数可知W为Na元素;Z与Q同主族,则Z、为O元素,据此进行解答.
解答 解:短周期原子序数依次增大的主族元素R、T、Q、W、Y、Z,其中R、Y原子的最外层电子数与电子层数相同,符合条件的元素有H、Be、Al;Q是地壳中含量最高的元素,则Q为O元素;由于R与T的核电荷数之和等于Q的核电荷数,Al原子序数大于O,R为Be时,T的原子序数为4,R、T原子序数相同,则R只能为H元素,Y为Al,则T的原子序数=8-1=7,即T为N元素;W与R同主族,结合原子序数可知W为Na元素;Z与Q同主族,则Z、为O元素,
A.Q与Y组成的常见物质是一种两性物质为Al2O3,属于离子化合物,不含共价键,故A错误;
B.WRZQ3为NaHSO3,其溶液呈酸性,说明亚硫酸氢根离子的电离程度大于其电离程度,将亚硫酸氢钠固体溶于水,亚硫酸氢根离子电离出的氢离子会抑制水的电离,故B错误;
C.Q与W形成的两种常见化合物为Na2O、Na2O2,二者含有阴、阳离子之比都是2:1,均属于离子化合物,故C正确;
D.同主族自上而下原子半径增大,同周期随原子序数增大原子半径减小,故原子半径:O<N<Al<Na,即Q<T<Y<W,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的应用,题目难度中等,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心理念是对环境污染进行综合治理 | |
| B. | 现代研制的油漆中一般不使用甲醛等化合物,因为这些化合物对人体有害 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
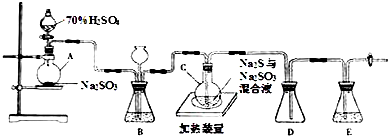
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
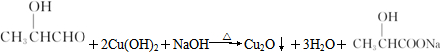 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4mol/(L•min) | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 若在恒容时充入与反应无关的气体Ar,由于增大了容器内的压强,而加快了反应速率 | |
| D. | 当B的消耗速率与C的消耗速率相等时,反应达到了平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
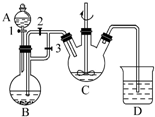 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
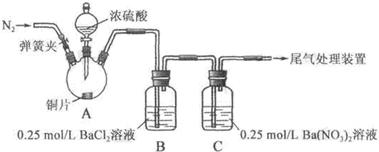
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Na2O2与足量的潮湿的二氧化碳反应转移的电子数为0.1NA | |
| B. | 1mol镁与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1 mol/L | |
| D. | 某密闭容器中盛有0.2molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com