
����Ŀ��T��ʱ����1L���ܱ������г���2mol CO2��6mol H2 �� ������Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g����H=��49.0kJmol��1 �� ���H2��CH3OH��g����Ũ����ʱ��仯�����ͼ��ʾ������˵������ȷ���ǣ� �� 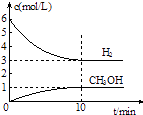
A.0��10min��v��H2��=0.3 mol?L��1?min��1
B.T��ʱ��ƽ�ⳣ��K= ![]() ��CO2��H2��ת�������
��CO2��H2��ת�������
C.T��ʱ������32 g CH3OH����ʱ���ų�49.0 kJ������
D.�ﵽƽ��������¶Ȼ��ٳ���CO2���壬���������H2��ת����
���𰸡�D
���������⣺���ͼ��֪Ũ�ȵı仯����
CO2��g�� | + | 3H2��g�� | CH3OH��g�� | + | H2O��g�� | ||
��ʼ | 2 | 6 | 0 | 0 | |||
ת�� | 1 | 3 | 1 | 1 | |||
ƽ�� | 1 | 3 | 1 | 1 |
A.0��10min��v��H2��= ![]() =0.3 molL��1min��1 �� ��A��ȷ��
=0.3 molL��1min��1 �� ��A��ȷ��
B��T��ʱ��ƽ�ⳣ��K= ![]() =
= ![]() ����ʼ��֮�ȵ��ڻ�ѧ������֮�ȣ���CO2��H2��ת������ȣ���B��ȷ��
����ʼ��֮�ȵ��ڻ�ѧ������֮�ȣ���CO2��H2��ת������ȣ���B��ȷ��
C��n��CH3OH��= ![]() =1mol�����ʵ����뷴Ӧ�������仯�����ȣ�����32 g CH3OH����ʱ���ų�49.0 kJ����������C��ȷ��
=1mol�����ʵ����뷴Ӧ�������仯�����ȣ�����32 g CH3OH����ʱ���ų�49.0 kJ����������C��ȷ��
D���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���H2��ת���ʼ�С������CO2����ƽ�������ƶ���H2��ת��������D����
��ѡD��
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ��㣬��Ҫ�˽⻯ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йس��ӵ�ʵ�������������(����)
A.��ȥ������̼�л��е�����һ����̼��ͨ�������������ȼ
B.��ȥ����������������ʹ����ͨ�����ȵ�ͭ��
C.��ȥʯӢ������̼��ƣ���ϡ�����ܽ�����
D.��ȥ�Ȼ��ƹ����������Ĵ�����������Ȼ��ƣ����ˡ��������ᾧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������л������ǿ����ʵ��ǣ� ��
A.Ӳ֬����B.����C.����D.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A(g)+B(g)=3C(g)+4D(g)��Ӧ�У���ʾ�÷�Ӧ���������ǣ� ��
A. v��A��=0.5mol����L�� s��-1 B. v��B��=0.3 mol����L�� s��-1
C. v��C��=0.8 mol����L�� s��-1 D. v��D��=1 mol����L�� s��-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A. ���˲���ʱ��©���²��ļ���Ҫ�����ձ����ڱ�
B. ��������������Һʱ�����ȱ��ò��������裬ֱ��Һ��ȫ������
C. ��ȡ����ʱ��Ӧѡ���л���ȡ��������ȡ�����ܶȱ����ˮ��
D. ʹ������ƿʱ��Ҫ�ȸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ϊ�����仯���ǣ� ��
A. ��������B. �������C. ұ������D. ��Ƴɴ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.�Ʊ�ͭ����άʱ��ȡ��ϡ�����е��������ˮϴ�ӣ��õ���ɫ��ͭ����ά
B.��Ȼ������Ҫ�ɷ��Ǽ��飬��ͬ������Ȼ���м��麬����ͬ
C.���ô�ŵ���ˮ��ת��Ϊ��ϡ������
D.��ȼ��ľ��ʱ����ľ�ļܿգ�ľ�Ļ�ȼ�յĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ж��л���ṹ�������в���ȷ���ǣ� ��
A.��ϩ���屽�����е�����ԭ�Ӿ���ƽ��
B.���л�������У����е���ԭ�Ӹ���һ����ż��
C.![]() ��
�� ![]() ����ͬ�����ʣ�˵����������6��̼ԭ��֮��ļ�����ȫһ����
����ͬ�����ʣ�˵����������6��̼ԭ��֮��ļ�����ȫһ����
D.CH2Cl2ֻ��һ�ֽṹ˵�������������������ṹ��������ƽ�������νṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ�����Ʊ�1��2���������鲢����һϵ�����ʵ���װ�ã����ȼ��г��豸���ԣ����й������б����£�
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/g/cm3 | 0.79 | 2.2 | 0.71 |
�е�/�� | 78.5 | 132 | 34.6 |
�۵�/�� | ��130 | 9 | ��116 |
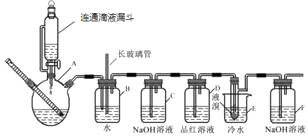
��1��A��ҩƷΪ1��3����ˮ�Ҵ���Ũ������Һ��ʹ����ͨ��Һ©�����ʹ�÷�Һ©���μ�Һ����ŵ�����B�в峤�����ܵ������У� ��
��2��д��Cװ���е����ӷ�Ӧ����ʽ��װ��D��Ʒ����Һ�������� ��
��3����Ӧ������Ӧ����ˮ��ȴװ��E������ҪĿ���������ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ���� ��
��4��ѧ�����ַ�Ӧ����ʱ����ˮ�Ҵ��������������ֵ����ԭ���� ��
��5��װ��F����������д��Fװ���з�����Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com