
【题目】晶体的性质与晶体类型和结构紧密相关。
(1)氯酸钾熔化时克服的作用力是______;二氧化硅熔化时克服的作用力是______;碘升华时克服的作用力是______。三种晶体的熔点由高到低的顺序是______(填化学式)。
(2)下列六种晶体:①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。
,⑥金刚石,它们的熔点从低到高的顺序为______(填序号)。
【答案】离子键 共价键 分子间作用力 ![]() ①<⑤<③<②<④<⑥
①<⑤<③<②<④<⑥
【解析】
(1)氯酸钾属于离子晶体,二氧化硅属于原子晶体,碘为分子晶体据此分析解答;
(2)一般而言,熔点:原子晶体>离子晶体>分子晶体,金属晶体需要具体情况,具体分析。
(1)氯酸钾为离子化合物,熔化时破坏离子键,二氧化硅是原子晶体,熔化时破坏共价键,碘为分子晶体,加热升华时发生物理变化,破坏分子间作用力;晶体的熔点高低顺序一般是:原子晶体>离子晶体>分子晶体,所以三种晶体的熔点由高到低的顺序是:二氧化硅>氯酸钾>碘;故答案为:离子键;共价键;分子间作用力;![]() ;
;
(2)一般而言,原子晶体>离子晶体>分子晶体,金属晶体的熔点相差很大。Si和金刚石都是原子晶体,原子半径越小,共价键越强,熔点越高,熔点Si<金刚石;氯化钠为离子晶体,熔点较高;CO2和CS2都是分子晶体,相对分子质量越大熔点越高,熔点CO2<CS2;Na的熔点低于100℃,![]() 在通常状况下是固态,而
在通常状况下是固态,而![]() 是液态,所以
是液态,所以![]() 的熔点高于
的熔点高于![]() ;所以熔点低到高的顺序为
;所以熔点低到高的顺序为![]() 金刚石,即①<⑤<③<②<④<⑥,故答案为:①<⑤<③<②<④<⑥;
金刚石,即①<⑤<③<②<④<⑥,故答案为:①<⑤<③<②<④<⑥;


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 与
与![]() 、
、![]() 与
与![]() 分别位于同一主族,
分别位于同一主族,![]() 与
与![]() 可形成共价化合物
可形成共价化合物![]() ,
,![]() 原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是( )
A.![]() 分子中的所有原子最外层都为8电子结构
分子中的所有原子最外层都为8电子结构
B.![]() 、
、![]() 的化学键类型相同
的化学键类型相同
C.![]() 是共价化合物
是共价化合物
D.原子半径:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析核电荷数为1 ~ 18的元素原子的核外电子层数和最外层电子数,回答下列问题:
(1)核电荷数为6和14的元素原子,它们的____________相同,____________不相同;核电荷数为15和16的元素原子,它们的____________相同,____________不相同;核电荷数为10和18的元素原子,它们的最外层电子数均为____________,它们的元素符号分别是____________、____________。
(2)某元素的原子核外有三个电子层,最外层电子数是核外电子总数的![]() ,该元素的元素符号是____________,原子结构示意图是____________。
,该元素的元素符号是____________,原子结构示意图是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素的原子序数均小于18,其最高正化合价依次为
四种元素的原子序数均小于18,其最高正化合价依次为![]() 、
、![]() 、
、![]() 、
、![]() 。已知
。已知![]() 元素原子的次外层电子数为2,
元素原子的次外层电子数为2,![]() 、
、![]() 元素原子的次外层电子数均为8,
元素原子的次外层电子数均为8,![]() 元素的最高价氧化物对应的水化物是已知含氧酸中的最强酸。试回答下列问题:
元素的最高价氧化物对应的水化物是已知含氧酸中的最强酸。试回答下列问题:
(1)![]() 、
、![]() 、
、![]() 、
、![]() 四种元素的名称分别是______、______、______、______。
四种元素的名称分别是______、______、______、______。
(2)![]() 的简单离子的结构示意图是______,
的简单离子的结构示意图是______,![]() 原子的结构示意图是______。
原子的结构示意图是______。
(3)![]() 的最高价氧化物对应的水化物与
的最高价氧化物对应的水化物与![]() 的氢氧化物反应可生成__________种盐,化学式分别为________________________。
的氢氧化物反应可生成__________种盐,化学式分别为________________________。
(4)![]() 、
、![]() 的简单氢化物的稳定性由强到弱的顺序是____________(用化学式表示)。
的简单氢化物的稳定性由强到弱的顺序是____________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
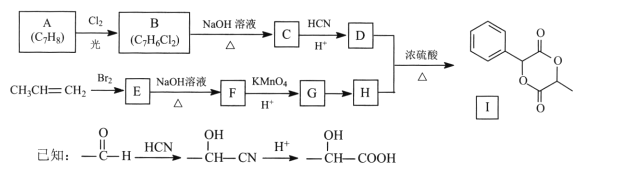
回答下列问题:
(l)C的名称是 ____,I的分子式为____。
(2)E→F的反应类型为____,G中官能团的名称为____ 。
(3) A→B的化学方程式为________。
(4)反应G→H的试剂及条件是________。
(5)写出符合下列条件的D的同分异构体:________。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种现取适量溶液进行如下一系列实验:
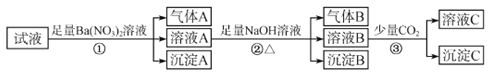
下列有关判断正确的是( )
A.试液中一定有Fe2+、SO42-、H+、NH4+、Al3+、NO3-
B.试液中一定没有Ba2+、CO32-、NO3-
C.步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
D.气体A、B之间肯定不能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种主族元素,已知:(a)A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等;(b)B、C原子核外电子层数比A原子少1,B的最高正价和最低负价的代数和等于零,C的简单气态氢化物的化学式是H2C;(c)D、E的阴离子都带有一个单位的负电荷,D的阴离子的电子层结构与氩原子相同,E元素没有对应的含氧酸;(d)F与A位于同一周期且是六种元素中原子半径最大的元素。
(1)写出六种元素的名称:A___;B___;C___;D___;E___;F___。
(2)A、C、D、F四种元素的简单离子的半径由大到小的顺序为____(用离子符号表示)。
(3)B、C、D三种元素的简单气态氢化物的稳定性由强到弱的顺序为___(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钍![]() Th的原子可发生下列放射性变化:
Th的原子可发生下列放射性变化: ![]() Th→
Th→![]() X+
X+![]() He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
He,生成的X是与Mg同主族的一种元素的原子,下列对X的推断错误的是
A. X的氢氧化物是一种强碱B. X元素位于第六周期
C. X的碳酸盐难溶于水D. X的最高化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
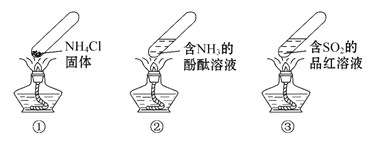
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com