
下列实验操作或事实与预期实验目的或所得结论一致的是

科目:高中化学 来源:2015年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:实验题
(14分)肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。CO(NH2) + 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是 ;
实验二:制取水合肼(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO=N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三:测定馏分中肼含量水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”);若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省宁波市高三一月化学试卷(解析版) 题型:选择题
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示)。已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种。若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是

A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4
D.用pH试纸检验,若常温下pH=7,则固体M一定是Na2SO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:实验题
(8分)溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
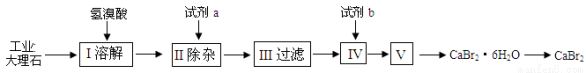
完成下列填空:
(1)上述使用的氢溴酸的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸的HBr 500ml,所需的玻璃仪器有玻璃棒、烧杯、量筒、 、 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0的目的是 。步骤Ⅳ的目的是 。
(3)制得的溴化钙可以通过如下步骤测定其纯度:
①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应后过滤、洗涤、干燥、称量。若得到1.88g碳酸钙,则溴化钙的质量分数为 (保留两位小数)。
②若实验操作规范而测定结果偏低,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
电离平衡常数 | K a=1.75×10-5 | K a=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
A.25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3
B.将0.1 mol·L-1的醋酸加水不断稀释,所有离子浓度均减小
C.少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省杭州地区7校高三上学期期末模拟联考化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列说法正确的是
A.1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA
B.标准状况下,11.2L氯仿中含有C-Cl键的数目为1.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.1 mol Na被完全氧化生成Na2O2,失去2 NA个电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:填空题
(10分)某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容如下:

根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省襄阳市高三1月调研理综化学试卷(解析版) 题型:填空题
[化学─选修5:有机化学基础](15分)
(一)2014年国际禁毒日的主题是“珍惜美好青春,远离合成毒品、拒绝毒品、健康人生”。下图是大麻的主要成分THC的结构式。

(1)该物质含有的官能团的名称为 ,它的分子式为 ,分子中手性碳原子数为 。
(2)下列关于THC的说法中正确的是
A.分子中含有苯环,属于芳香烃类化合物
B.难溶于水,易溶于乙醇、乙醚、苯和碱溶液
C.可以发生加成反应、取代反应、氧化反应、消去反应
D.除氢原子外,分子中所有的其它原子都在一个平面上
E.遇FeCl3溶液显紫色;可以使溴的四氯化碳溶液褪色
F.通常状态下,1mol该物质最多可与3mol Br2发生反应
(二)香豆素是重要的香料、医药中间体。某研究小组设计的合成香豆素路线如下:

提示:2CH3CHO+(CH3CO)2O 2CH3CH=CHCOOH+H2O
2CH3CH=CHCOOH+H2O
(1)A→B的化学方程式为 。
(2)D的核磁共振氢谱图中的吸收峰有 个。反应⑤的有机反应类型是 反应。H的结构简式为 。
(3)已知芳香族化合物I是G的同分异构体,且I的苯环上只有一个取代基。则I的结构简式可能为
。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三12月月考化学试卷(解析版) 题型:选择题
下列图像表达正确的是
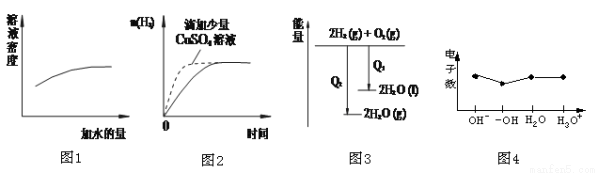
A.图1表示浓硫酸的稀释
B.图2表示过量的盐酸与等量的锌粉反应
C.图3表示氢气与氧气反应中的能量变化
D.图4表示微粒电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com