
| A. | 在0.1mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) | |
| B. | 等物质的量的NaClO、NaHCO3的混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) | |
| C. | 0.01mol•L-1NaOH溶液与等体积pH=2的醋酸溶液混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | 醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
分析 A.任何电解质溶液中都存在质子守恒,根据质子守恒判断;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.0.01mol/L的NaOH溶液浓度小于pH=2的醋酸溶液,二者等体积混合,醋酸物质的量大于NaOH,醋酸有剩余,溶液呈酸性,再结合电荷守恒判断;
D.混合溶液中存在电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),混合溶液呈中性,则c(H+)=c(OH-),所以存在c(Na+)=c(CH3COO-)+c(Cl-),醋酸钠中存在物料守恒c(Na+)=c(CH3COOH)+c(CH3COO-).
解答 解:A.任何电解质溶液中都存在质子守恒,根据质子守恒得c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),所以得c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3),故A正确;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)=$\frac{1}{2}$c(Na+),故B正确;
C.0.01mol/L的NaOH溶液浓度小于pH=2的醋酸溶液,二者等体积混合,醋酸物质的量大于NaOH,醋酸有剩余,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(CH3COO-)>c(Na+),醋酸电离程度较小,所以溶液中离子浓度大小顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.混合溶液中存在电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(Cl-)+c(OH-),混合溶液呈中性,则c(H+)=c(OH-),所以存在c(Na+)=c(CH3COO-)+c(Cl-),醋酸钠中存在物料守恒c(Na+)=c(CH3COOH)+c(CH3COO-),所以得c(CH3COOH)=c(Cl-),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中的溶质及其性质是解本题关键,注意守恒思想的灵活运用,易错选项是D,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体 | |
| C. | 装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 | |
| D. | 煤经过气化和液化两种物理变化,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
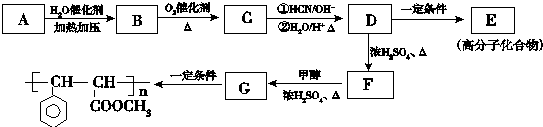
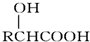
 .
. .
.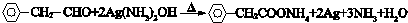 .
. .
.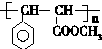 与足量氢氧化钠溶液反应的化学方程式
与足量氢氧化钠溶液反应的化学方程式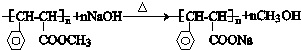 .
.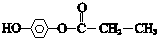 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
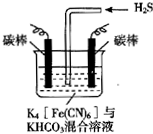 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- | |
| B. | 电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 2.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>F | |
| B. | 人们可在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料 | |
| C. | 短周期元素正化合价数值和其族序数相同 | |
| D. | 短周期元素形成的微粒X2-与 Y2+核外电子排布相同,离子半径:X2->Y2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com