
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi元素位于元素周期表第六周期第VA族 | |
| D. | Bi为放射性元素 |
分析 由题意可知,原子序数为83,Bi元素的相对原子质量为209,而稀有气体中原子序数依次为2、8、18、36、54、86,Bi与86号元素相差3,则Bi处于第六周期ⅤA族,最高正化合价为+5.
解答 解:稀有气体中原子序数依次为2、8、18、36、54、86,Bi与86号元素相差3,则Bi处于第六周期ⅤA族,最高正化合价为+5.
A.元素是一类原子的总称,不谈质量数,Bi元素的相对原子质量为209,故A错误;
B.Bi元素最高正化合价为+5,最高价氧化物的化学式为Bi2O5,故B错误;
C.由上述分析可知,Bi元素位于元素周期表第六周期第ⅤA族,故C正确;
D.Bi元素不是放射性元素,故D错误.
故选C.
点评 本题考查结构位置性质关系,关键是根据元素序数确定元素在周期表中的位置,注意对元素周期律的理解掌握,题目难度不大.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.02 mol/(L•s) | B. | 3.6 mol/(L•s) | C. | 1.2 mol/(L•s) | D. | 0.04mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X元素能形成+7价的含氧酸及其盐 | |
| B. | Y元素的原子最外电子层上有2个电子 | |
| C. | Z元素的氢氧化物是两性氢氧化物 | |
| D. | R元素的阴离子与同一周期稀有气体元素原子的电子层结构相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
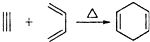 ,如果要合成
,如果要合成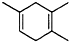 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 只有① | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:11 | B. | 11:3 | C. | 2:3 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com