
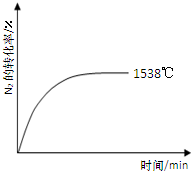
 ��Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��
��Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��| �¶�/�� | 1538 | 1760 | 2404 |
| ƽ�ⳣ��K | 0.86��10-4 | 2.6��10-4 | 64��10-4 |
 ��
�� ��
��| [NO]2 |
| [N2][O2] |
| (2x)2 |
| (2.6-x)2 |
| 0.2mol |
| 1L |


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��
��Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��| �¶�/�� | 1538 | 1760 | 2404 |
| ƽ�ⳣ��K | 0.86��10-4 | 2.6��10-4 | 64��10-4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
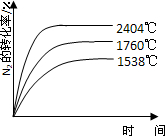
��6�֣���Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��
��1���ڲ�ͬ�¶��£���ӦN2(g)��O2(g)2NO(g) DH��a kJ��mol��1��ƽ�ⳣ��K���±���
| �¶�/�� | 1538 | 1760 | 2404 |
| ƽ�ⳣ��K | 0.86��10��4 | 2.6��10��4 | 64��10��4 |
�÷�Ӧ�ġ�H 0�����������������������
(2)2404��ʱ�����ݻ�Ϊ1.0L���ܱ�������ͨ��2.6molN2��2.6mol O2�����㷴Ӧ��
N2(g)��O2(g)2NO(g)�ﵽƽ��ʱN2��Ũ��Ϊ �������¶��²�����O2��NO�ķ�Ӧ��������������λ��Ч���֣�
(3)��ѧ��һֱ�������о����³�ѹ�¡��˹��̵������·���������ʵ�鱨�����ڳ��¡���ѹ���������£�N2�ڴ���(��������Fe2O3��TiO2)������ˮ������Ӧ�����ɵ���Ҫ����ΪNH3����Ӧ���Ȼ�ѧ����ʽ���£�
2N2(g)��6H2O(1)��4NH3 (g)��3O2(g) DH����1530kJ��mol��1
��������Ӧ4NH3(g)��5O2(g)��4NO(g)��6H2O(1)�ķ�Ӧ��DH�� �� ���ú�a�Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011��㶫ʡ��������ͨ���б�ҵ���ۺϲ��ԣ����������ۣ���ѧ���� ���ͣ������
��Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��
��1����Ӧ��Ҫ��������������·�����˵���÷�Ӧ_________��������ĸ��
A������Ļ�ܸܺ� B�����յ������ܶ�
��2���ڲ�ͬ�¶��£���ӦN2(g)��O2(g) 2NO(g)��ƽ�ⳣ��K���±���
2NO(g)��ƽ�ⳣ��K���±���
| �¶�/�� | 1538 | 1760 | 2404 |
| ƽ�ⳣ��K | 0.86��10��4 | 2.6��10��4 | 64��10��4 |
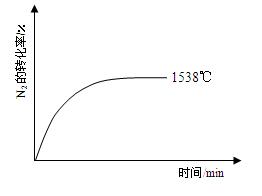
 2NO(g)�ﵽƽ��ʱNO��Ũ�ȡ������¶��²�����O2��NO�ķ�Ӧ��������������λ��Ч���֣�
2NO(g)�ﵽƽ��ʱNO��Ũ�ȡ������¶��²�����O2��NO�ķ�Ӧ��������������λ��Ч���֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�츣��ʦ���и߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
����4�֣���Ȼ���ﵪ�Ĺ̶�;��֮һ��������������£�N2��O2��Ӧ����NO��
��1����Ӧ��Ҫ��������������·�����˵���÷�Ӧ_________��������ĸ��
���� A������Ļ�ܸܺߡ����������� B�����յ������ܶ�
��2���ڲ�ͬ�¶��£���ӦN2(g)��O2(g) 2NO(g)��ƽ�ⳣ��K���±���
2NO(g)��ƽ�ⳣ��K���±���
|
�¶�/�� |
1538 |
1760 |
2404 |
|
ƽ�ⳣ��K |
0.86��10��4 |
2.6��10��4 |
64��10��4 |
�÷�Ӧ�ġ�H���������� 0�����>������=����<����
��3��2404��ʱ�����ݻ�Ϊ1.0L���ܱ�������ͨ��2.6mol N2��2.6mol O2�����㷴ӦN2(g)��O2(g)  2NO(g)�ﵽƽ��ʱNO��Ũ��Ϊ
�������¶��²�����O2��NO�ķ�Ӧ��������������λ��Ч���֣�
2NO(g)�ﵽƽ��ʱNO��Ũ��Ϊ
�������¶��²�����O2��NO�ķ�Ӧ��������������λ��Ч���֣�
����(5��)���ݻ�Ϊ1L���ܱ������У��������·�Ӧ��A��g��+2B��g�� C��g��+D��g������ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
C��g��+D��g������ͬ�¶��£�D�����ʵ���n��D����ʱ��t�Ĺ�ϵ��ͼ���Իش��������⣺
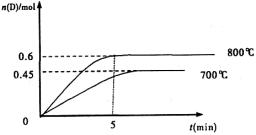
(1)���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�������������������������������� ��
A��������ѹǿ���䡡����������������B�����������c��A������
C��2v����B��=v����D����������������D��c��A��=c��C��
(2)���������1.0molA��2.2molB������ͼ�����ݼ���800��ʱ��ƽ�ⳣ��
K=�������� ���÷�ӦΪ������������������������������Ӧ�������Ȼ���ȣ�
(3)700��ʱ��ijʱ�̲����ϵ�и����ʵ������£�n��A��=1.1mol��n��B��=2.6mol��n��C��=0.9mol��n��D��=0.9mol�����ʱ�÷�Ӧ���������������� ���У��������Ӧ�������淴Ӧ������ƽ��״̬������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com