
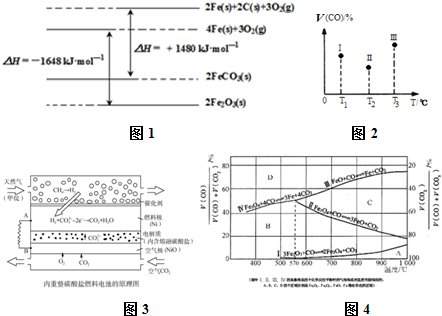
分析 (1)图1分析书写热化学方程式,结合C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1和盖斯定律计算得到FeCO3在空气中煅烧生成Fe2O3的热化学方程式;
(2)①2min后达到平衡,测得Fe2O3在反应中质量减少4.8g,依据化学方程式反应前后质量变化计算生成氢气的物质的量,根据反应速率概念计算得到氢气的反应速率;
②反应达到平衡状态时,正逆反应速率相等,各组分浓度保持不变,据此分析;
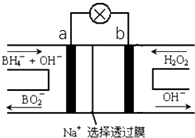
③2Fe(s)+3CO(g)+6H2(g)═Fe2O3(s)+3CH4(g),根据图2中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,由小到大,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小,据此判断Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)△H大小;
④该燃料电池中,通入甲烷的一极为原电池的负极,发生氧化反应,根据图示信息知道负极电极反应式为:H2-2e-+CO32-=CO2+H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-,
(3)800℃时,混合气体中CO2体积分数为40%时,图象分析可知Fe2O3用CO还原得到氧化亚铁和一氧化碳;
(4)A.加水稀释,则水解平衡正向移动;
B.固体不能影响化学平衡;
C.控制条件使平衡正向移动,水解为吸热反应,所以升温平衡正向移动;
D.加入碳酸钠,则消耗氢离子,平衡正向移动.
解答 解:(1)①C(s)+O2(g)=CO2(g)△H=-393kJ•mol-1
铁及其化合物反应的焓变示意图如图1:写出热化学方程式为:
②2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=+1480KJ/mol,
③4Fe(s)+3O2(g)=2Fe2O3(s)△H=-1648KJ/mol
盖斯定律计算①×4-(②×2-③)得到FeCO3在空气中煅烧生成Fe2O3的热化学方程式:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 kJ•mol-1,
故答案为:4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g)△H=-260 kJ•mol-1;
(2)①Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)
1mol 6mol
$\frac{4.8g}{160g/mol}$ n
n=0.18mol
氢气表示的反应速率=$\frac{\frac{0.18mol}{3L}}{2min}$=0.03 mol•L-1•min-1,
故答案为:0.03 mol•L-1•min-1;
②A.反应中生成CO和H2的物质的量之比始终为1:2,不能说明反应正逆反应速率相同,故A错误;
B.反应前后气体质量不变,气体体积不变,当混合气体的密度不再改变是没反应达到平衡状态,故B正确;
C.铁的物质的量不再改变说明反应达到平衡状态,故C正确;
D.反应速率之比等于化学方程式计量数之比,为正反应速率之比,2 v正(CO)=v逆(H2)说明反应达到平衡状态,v正(CO)=2v逆(H2)不能说明反应正逆反应速率相同,故D错误;
故答案为:BC;
③在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入a molCO和2amol H2,2Fe(s)+3CO(g)+6H2(g)═Fe2O3(s)+3CH4(g),根据图2中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,2Fe(s)+3CO(g)+6H2(g)═Fe2O3(s)+3CH4(g),该反应正反应为放热反应,上述反应Fe2O3(s)+3CH4(g)═2Fe(s)+3CO(g)+6H2(g)的△H大于0,
故答案为:III,大于;
④根据电极反应:负极电极反应式为:H2-2e-+CO32-=CO2+H2O,通入空气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为O2+4e-+2CO2=2CO32-,电解精炼铜,阴极上铜离子得到电子生成铜,电极反应Cu2++2e-=Cu,当电路有0.1mol e-转移反应生成铜0.05mol,如果全部是铜放电,则溶解的铜的质量=0.05mol×64g/mol=3.2g,粗铜有比铜更活泼的金属首先放电,所以溶解的铜小于3.2g,
故答案为:O2+4e-+2CO2═2CO32-,<;
(3)800℃时,混合气体中CO2体积分数为40%时,由图可知,“800℃、CO2体积分数为40%”时,在C区,此时为FeO的稳定区域,故产物为FeO,Fe2O3用CO还原得到氧化亚铁和一氧化碳,反应的化学方程式为:Fe2O3+CO$\frac{\underline{\;800℃\;}}{\;}$2FeO+CO2,
故答案为:Fe2O3+CO $\frac{\underline{\;800℃\;}}{\;}$ 2FeO+CO2;
(4)A.加水稀释,促进水解平衡正向移动,故A不符合;
B.固体不能影响化学平衡,加入少量铁粉平衡不变,故B符合;
C.水解为吸热反应,所以升温平衡正向移动,故C不符合;
D.加入碳酸钠,和水解生成的氢离子反应消耗氢离子,促进平衡正向移动,故D不符合;
故答案为:B;
点评 本题考查了图象分析判断的方法应用,主要是热化学方程式书写、平衡计算和平衡标志分析、原电池原理的分析判断和电极反应的分析判断,掌握基础是解题的关键,题目难度中等.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
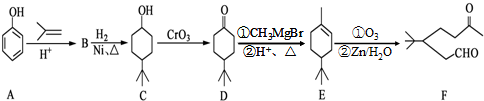
 硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )| A. | 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 | |
| B. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 电池放电时Na+从b极区移向a极区 | |
| D. | 电池的负极反应为BH4-+2H2O-8e-═BO2-+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移的电子数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| C. | 在30g二氧化硅晶体中含有的共价键数目为2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体冷却至标准状况,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.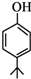 .同时满足下列条件的B的同分异构体(不包括B)共有11种:
.同时满足下列条件的B的同分异构体(不包括B)共有11种: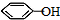 )和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线
)和烃W为主要原料制备有机物3-乙基-1,6-已二酸的合成路线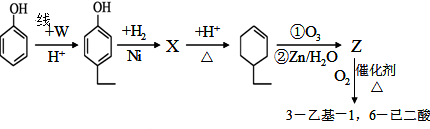
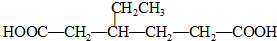
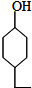 ,Z:
,Z: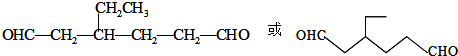 ;
;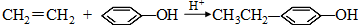 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,能稳定存在的R的氧化物都是酸性氧化物 | |
| B. | R的气态氢化物的水溶液具有强酸性 | |
| C. | R是金属元素 | |
| D. | R的气态氧化物不能在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com