
【题目】为测定某氟化稀土样品中氟元素的质量分数进行如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量,实验装置如图所示。

(1)c的名称是________________
(2)检查装置气密性:在b和f中加水,水浸没导管a和e末端,______________(填操作步骤),微热c,容量瓶f有气泡冒出,导管a内形成一段水柱;停止加热,_________________________,说明装置气密性良好。
(3)c中加入一定体积高氯酸和m g氟化稀土样品,f中盛有滴加酚酞的NaOH溶液。加热b、c,使水蒸气进入c。
①向c中通水蒸气的目的是________________________________;
②c中除有HF气体外,可能还有少量SiF4(易水解)气体生成,若有SiF4生成,实验结果将__________(填“偏高”“偏低”或”不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因_______________________________。
(4)向馏出液中加入V1ml c1 mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2 mol·L-1 EDTA标准溶液滴定剩余的La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2 mL,则氟化稀土样品中氟的质量分数为____________(写出表达式即可,不需化简)。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏实验),测量并计算出氟元素质量,重复多次。该操作的目的是_________________________________________。
【答案】三颈烧瓶 关闭k1 导管 a中液面下降,导管e内形成一段水柱 将C中产生的HF完全蒸出,被f中溶液吸收 不受影响 充分吸收HF气体,防止其挥发损失 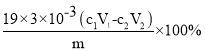 寻找最佳实验条件
寻找最佳实验条件
【解析】
(1)由仪器c的结构可知其为三颈烧瓶;
(2)检查装置气密性:在bf中加入水,水浸没ae导气管口形成密闭装置,关闭k,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。
(3)①向三颈烧瓶中不断通水蒸气达到将C中产生的HF完全蒸出,被f中溶液吸收的目的;
②实验中除有HF气体外,可能含有少量SiF4气体,四氟化氢易水解生成HF,若有SiF4生成,对实验结果不受影响;
③若观察到f中溶液红色褪去,需要向f中及时补加氢氧化钠溶液,否则会使实验结果偏低,原因是充分吸收HF气体防止其挥发损失,造成测定误差;
(4)向馏出液中加入V1mL c1molL-1La(NO3),溶液,得到LaF3沉淀,再用c2molL-1EDTA标准溶液滴定剩余La3+(1a3+与EDTA按1:1络合),消耗EDTA标准溶液V2mL,则氟化稀土样品中氟的质量分数=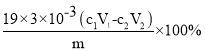 ;
;
(5)用样品进行试验前需要用0.084g氟化钠代替样品进行试验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次,该操作的目的是通过做对比实验,寻找最佳实验条件。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】4-羟基扁桃酸可用于制备抗生素及血管扩张类的药物,香豆素-3-羧酸可用于制造香料,二者合成路线如下(部分产物及条件未列出):
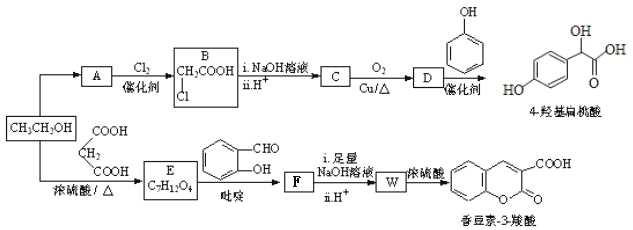
已知;
![]() (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)
(1)A相对分子质量为60,常在生活中用于除去水壶中的水垢,A的结构简式是___________。
(2)D → 4-羟基扁桃酸反应类型是______________。
(3)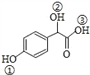 中①、②、③ 3个-OH的电离能力由强到弱的顺序是___________。
中①、②、③ 3个-OH的电离能力由强到弱的顺序是___________。
(4)W →香豆素-3-羧酸的化学方程式是______________________。
(5)关于有机物F下列说法正确的是__________。
a.存在顺反异构 b.分子中不含醛基
c.能发生加成、水解、氧化等反应 d. 1mol F 与足量的溴水反应,最多消耗 4 molBr2
(6)某兴趣小组将 4-羟基扁桃酸进行如下操作
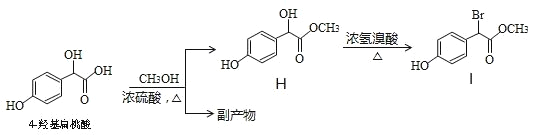
①1molH在一定条件下与足量NaOH溶液反应,最多消耗NaOH的物质的量为______mol.
②符合下列条件的 I 的同分异构体(不考虑立体异构)为______种。
a.属于一元羧酸类化合物
b.苯环上只有 2 个取代基,其中一个是羟基
③副产物有多种,其中一种是由 2 分子 4-羟基扁桃酸生成的含有 3 个六元环的化合物,该分子中不同化学环境的氢原子有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过一步反应不能直接完成的是:( )
①N2→NO2②NO2→NO ③NH3→NO
④NH3→NO2⑤Cu→Cu(NO3)2⑥HNO3→NO2
A.①⑥B.②⑤C.④⑤D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为蔗糖酶作用机理示意图,下列说法正确的是( )

A.该示意图说明酶具有高效性
B.图示过程能够保证酶保持较高的催化活性
C.一分子蔗糖可以水解为2分子葡萄糖
D.蔗糖酶不能催化麦芽糖水解是因为它们不能结合形成酶﹣底物复合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3—、CO32—、SO42—中的几种,为分析其成分,分别取废水样品100mL,进行了三组实验,其操作和有关图像如下所示:

请回答下列问题:
(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_________________,一定存在的阳离子是__________________________。
(2)写出实验③图像中沉淀开始减少至完全消失阶段发生反应的离子反应方程式:__________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为______________________,所得沉淀的最大质量是_____________________g。
(4)若通过实验确定原废水中c(Na+)=0.14 mol·L1,试判断原废水中NO3是否存在?_______(填“存在”“不存在”或“不确定”)。 若存在,c(NO3)=___________mol·L1。(若不存在或不确定则此空不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于“同位素”、“同素异形体”、“同系物”、“同分异构体”的说法合理的是 ( )
A. 同位素是指质量数相同,中子数不同的同种元素的不同原子
B. 同素异形体是指由同种元素形成的不同单质
C. 互为同分异构体的两种物质分子式相同,化学性质一定相似
D. 具有相同的通式,组成上相差若干个“![]() ”原子团的有机物一定互为同系物
”原子团的有机物一定互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铁铵[aFe2(SO4)3·b(NH4)2SO4·cH2O]广泛用于城镇生活饮用水、工业循环水的净化等。某化工厂以硫酸亚铁(含少量硝酸钙)和硫酸铵为原料,设计如图工艺流程制取硫酸铁铵。
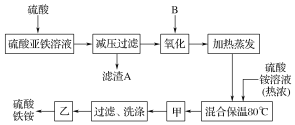
请回答下列问题:
(1)硫酸亚铁溶液加硫酸酸化的主要目的是________。
(2)下列物质中最适合的氧化剂B是________。
a.NaClO b.H2O2 c.KMnO4 d.K2Cr2O7
(3)操作甲的名称是_____。
(4)上述流程中,氧化之后和加热蒸发之前,需加入少量______(填化学式),检验Fe2+是否已全部被氧化的方法为_______________。
(5)称取14.00 g所得产品,将其溶于水配制成100 mL溶液,分成两等份,向其中一份溶液中加入足量NaOH溶液,过滤、洗涤得到2.14 g沉淀;向另一份溶液中加入含0.05 mol Ba(NO3)2的溶液,恰好完全反应,则该硫酸铁铵的化学式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:________________________。
(2)某小组按照文献中制备ClO2的方法设计了如图所示的实验装置用于制备ClO2。

①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____________________。
②装置B的作用是__________________。
③装置A用于生成ClO2气体,该反应的化学方程式为__________________。
④当看到装置C中导管液面上升时应进行的操作是______________________。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入_______________________作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(I2+2S2O32- = 2I- +S4O62-),当看到____________________________现象时,测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。从工业废水中回收硫酸亚铁和金属铜的工艺流程如图所示。
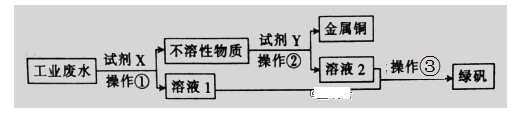
(1)操作③的名称为__________ 。
(2)试剂X为__________(填化学式),操作②涉及的离子反应方程式为__________ 。
Ⅱ.(3)研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5 价砷(As)元素,但它对人体是无毒的,砒霜的成分是 As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素 C=砒霜。该使人中毒过程中维生素 C 是________(填“氧化剂”或“还原剂)
(4)已知某反应中反应物和生成物有:KMnO4、H2SO4、MnSO4、H2C2O4、K2SO4、H2O和一种未知物X。
①若0.5 molH2C2O4在反应中失去1 mol电子生成X,则X的化学式为__________ 。
②将氧化剂和还原剂及配平的系数填入下列方框中,并用单线桥标出电子转移的方向和 数目。__________
![]()
③若已知H2C2O4为弱酸,试写出该反应的离子方程式:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com