
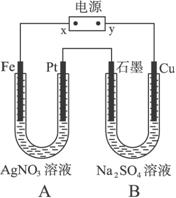
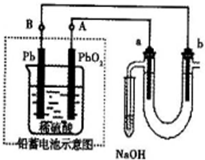
(1)电源上x为_________极。
(2)B池中阳极的电极反应式是_____________。
(3)标准状况时,如果在A中共收集到0.56 L气体,则A池中的pH为_____________。
解析:本题考查电解池的原理及有关电极反应的计算,要求会判断装置的类型,确定阴极和阳极,并进行电极反应计算。主要考查观察能力、逻辑思维能力等。
(1)解题的切入点是“通电一段时间后,Pt片上有气体生成”,显然是溶液中的氢氧根离子失电子放出的氧气,由此确定Pt片是阳极,依次类推,石墨是阴极,Cu是阳极,Fe是阴极。所以x是负极,y是正极。
(2)B池中阳极是Cu,其附近聚集有较多的OH-和![]() ,但失电子能力:Cu>OH->
,但失电子能力:Cu>OH->![]() ,所以有反应Cu-2e-====Cu2+
,所以有反应Cu-2e-====Cu2+
(3)Pt片上的电极反应式为4OH--4e-====2H2O+O2↑,可求得:n(OH-)=0.1 mol,则c(OH-)=0.1 mol·L-1。由水电离出的H+和OH-相等,所以c(H+)=0.1 mol·L-1,pH=1。
答案:(1)负 (2)Cu-2e-====Cu2+ (3)1


科目:高中化学 来源: 题型:阅读理解
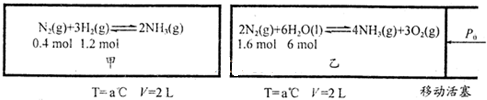
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
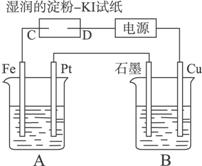
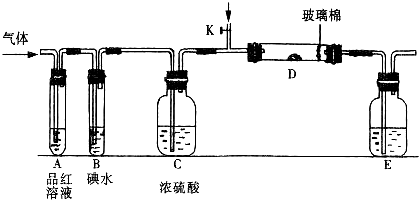
(1)A中发生反应的化学方程式为_______________________________________________。
(2)在B中观察到的现象为_______________________________________________________
____________________________________________________________________。
(3)室温下,若从电解开始到时间为t时,A、B装置中共收集到气体0.168 L(标准状况),若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液的pH为_____________。
查看答案和解析>>
科目:高中化学 来源:0110 期末题 题型:填空题



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com