
| A. | 硫化氢在氧气中燃烧 | B. | 铁在硫蒸气中燃烧 | ||
| C. | 二氧化硫通入石灰水 | D. | 锌粉和硫酸反应 |
分析 A.H2S在少量O2中燃烧生成S,在过量O2中燃烧生成SO2;
B.铁与硫蒸汽反应生成硫化亚铁;
C.少量SO2通人石灰水生成CaSO3,过量SO2通人石灰水生成Ca(HSO3)2;
D.锌和稀硫酸反应生成氢气,与浓硫酸反应生成二氧化硫.
解答 解:A.H2S在少量O2中燃烧生成S,在过量O2中燃烧生成SO2,所以生成物与反应物的量有关,故A错误;
B.铁与硫蒸汽反应生成硫化亚铁,所以产物与反应物浓度、反应物的量无关,故B正确;
C.二氧化硫通入石灰水,生成物用二氧化硫用量用过,二氧化硫少量反应生成亚硫酸钙,二氧化硫过量反应生成亚硫酸氢钙,故C错误;
D.锌稀硫酸则生成氢气,H2SO4+Zn═ZnSO4+H2↑;锌与浓硫酸则生成二氧化;Zn+2H2SO4(浓)$\frac{\underline{\;加热\;}}{\;}$ZnSO4+SO2↑+2H2O,硫酸浓度不同,产物不同,故D错误;
故选B.
点评 本题考查物质之间反应,明确物质性质是解本题关键,部分反应中与反应物的量、反应物浓度、反应温度有关,注意总结归纳,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 熔点/℃ | 沸点/℃ | 密度/g•mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
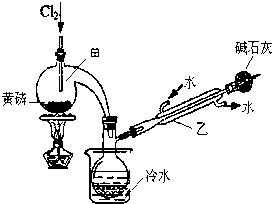
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减压蒸馏可以防止炭化结焦 | |
| B. | 石油裂化的目的是提高汽油的产量和质量 | |
| C. | 石油的常压蒸馏,减压蒸馏以及煤的干馏都是物理变化 | |
| D. | 芳香烃的主要来源是石油的催化重整和煤的干馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 是由三种单体通过加聚反应而制得的.这三种单体的结构简式是CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.
是由三种单体通过加聚反应而制得的.这三种单体的结构简式是CH2=C(CH3)-CH=CH2、CH3-CH=CH2、CH2=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰升华时要吸收热量,所以这是吸热反应 | |
| B. | 化学反应中能量的变化都表现为热量的变化 | |
| C. | 1 mol Ba(OH)2与1 mol H2SO4反应释放的热量为Q,则Q为它们反 应的中和热 | |
| D. | 物质燃烧可看成“储存”在物质内部的能量(化学能)转化为热能 释放出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
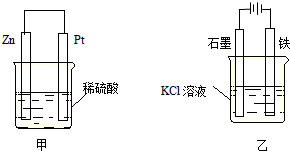
| A. | 该装置能形成原电池,其中锌是负极 | |
| B. | 该装置能形成原电池,其中铜是负极 | |
| C. | 该装置不能形成原电池 | |
| D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 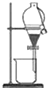 用于分离水和乙醇的混合物 | |
| B. | 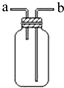 可用于H2,NH3,CO2,Cl2,HCl,NO2等气体收集 | |
| C. | 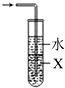 当X选用苯时可进行NH3和HCl的吸收,并防止倒吸 | |
| D. | 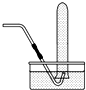 常用于实验室收集氧气、氢气等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com