

分析 (1)铁离子与硫氰根离子结合生成硫氰化铁,据此书写离子方程式;
(2)亚硫酸钡能够溶于盐酸,而硫酸钡不溶于盐酸,用盐酸可以鉴别;
(3)二氧化硫具有漂白性,能够使品红溶液褪色,据此可检验二氧化硫;
(4)二氧化硫有毒,多余的二氧化硫需要用氢氧化钠溶液吸收.
解答 解:(1)KSCN检验Fe3+反应生成硫氰化铁,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(2)BaSO4不溶于盐酸,而BaSO3溶于盐酸,可用盐酸鉴别二者,操作方法为:取Ⅰ中白色沉淀,加入足量稀盐酸,若沉淀不溶解且无气泡产生,则沉淀为BaSO4;
氯化钡不与二氧化硫反应,生成的沉淀为硫酸钡沉淀,则乙同学说法合理,
故答案为:取Ⅰ中白色沉淀,加入足量稀盐酸,若沉淀不溶解且无气泡产生,则沉淀为BaSO4;乙;
(3)SO2能够使品红溶液褪色,装置II中试剂为品红溶液,若品红溶液褪色,证明生成产物中含有二氧化硫,
故答案为:检验产生的气体中含SO2;品红溶液褪色;
(4)装置III中试剂为NaOH溶液,氢氧化钠溶液能够与二氧化硫反应,避免污染空气,
故答案为:除去多余的SO2,防止污染空气.
点评 本题考查性质方案的设计,题目难度不大,明确实验目的为解答关键,注意熟练掌握常见元素及其化合物性质,试题有利于提高学生的分析能力及化学实验能力.


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:选择题
| A. | PM2.5亦称可入肺颗粒物,表面积相对较大,会吸附有害物质 | |
| B. | 煤的气化和石油的分馏都是物理变化 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | “嫦娥”三号使用的碳纤维是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b互为同分异构体 | B. | b和c是同系物 | ||
| C. | a和b都能发生加成反应 | D. | 只有b和c能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
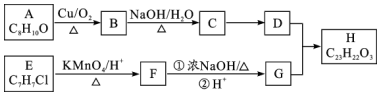
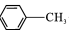 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$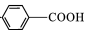
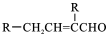
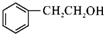 ,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为
,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为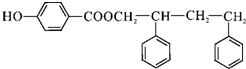 ;
; ;
; ;
;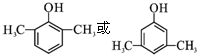 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 4.0 | 5.8 | 1.1 | 5.4 |
| 完全沉淀的pH | 5.2 | 8.8 | 3.2 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | ||
| b | ||
| c |
| A. | 氯、氟、硫 | B. | 氟、硫、砷 | C. | 氦、氟、氯 | D. | 氖、氯、硒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com