
【题目】某温下气体反应达到化学平衡,平衡常数K=![]() ,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
,恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A.降低温度,正反应速率增大
B.增大c(A)、c(B),K增大
C.向容器中充入稀有气体X,压强增大,反应速率不变
D.该反应的化学方程式为2E(g)+F(s)![]() A(g)+2B(g)
A(g)+2B(g)
科目:高中化学 来源: 题型:
【题目】Na2CO3固体中可能含有杂质K2CO3、NaHCO3、NaCl中的一种或几种,取10g样品,加入一定量的稀盐酸产生气体4.4g,下列分析正确的是( )
A.一定含有NaHCO3B.一定含有K2CO3
C.可能含有NaHCO3D.一定含有NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是()
A.2CH4(g)+4O2(g)=2CO2(g)+4H2O(l)ΔH=+890kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890kJ·mol-1
C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=-890kJ·mol-1
D.![]() CH4(g)+O2(g)=
CH4(g)+O2(g)=![]() CO2(g)+H2O(l)ΔH=-890kJ·mol-1
CO2(g)+H2O(l)ΔH=-890kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+1/2O2(g)=H2O(g)
反应过程中能量变化如下图:
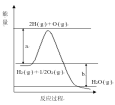
回答下列问题:
(1)图中a,b分别代表什么意义?
a_______________,b______________________。
(2)该反应是____反应(填“吸热”或“放热”),△H____(填“<0”或“>0”)。
(3)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g) ΔH2=-393.5kJ/mol
③H2(g)+![]() O2(g)═H2O(l) ΔH3=-285.8kJ/mol
O2(g)═H2O(l) ΔH3=-285.8kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式__________________。
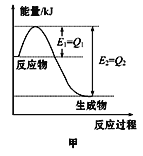
(4)图甲是一定的温度和压强下N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(ΔH的数值用含字母Q1、Q2的代数式表示):___________。
(5)科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
已知:CO的燃烧热△H2=-283kJ·moL-1。几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能/kJ·moL-1 | 945 | 498 | 630 |
N2(g)+O2(g)=2NO(g)△H3=____________,上述反应的△H1=_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO) /mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO) /mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)若1molNO和1molCO的总能量比1molCO2和0.5molN2的总能量大,则上述反应的![]() ___0(填写“>”、“<”、“=”)。
___0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)计算4s时NO的转化率为____________。
(4)下列措施能提高NO和CO转变成CO2和N2的反应速率的是______(填序号)。
A.选用更有效的催化剂B.升高反应体系的温度
C.降低反应体系的温度D.缩小容器的体积
(5)由上表数据可知,该反应在第______s达到化学平衡状态。假如上述反应在密闭恒容容器中进行,判断该反应是否达到平衡的依据为________(填序号)。
A.压强不随时间改变B.气体的密度不随时间改变
C.c(NO)不随时间改变D.单位时间里消耗NO和CO的物质的量相等
(6)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | NO初始浓度/mol·L-1 | CO初始浓度/mol·L-1 | 催化剂的比表面积/m2·g-1 |
Ⅰ | 280 | 1.20×10-3 | 82 | |
Ⅱ | 5.80×10-3 | 124 | ||
Ⅲ | 350 | 124 |
①请在上表格中填入剩余的实验条件数据_____、_____、______、______、______。
②请在给出的坐标图中,画出上表中的Ⅰ、Ⅱ两个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g) ![]() 2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) ![]() H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应 2A(?)+B(g) ![]() 2C(?) 已达平衡,则AC 不能同时是气体
2C(?) 已达平衡,则AC 不能同时是气体
D.C(s)+H2O(g) ![]() H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种强电解质,它们溶于水在水中电离出的阳离子有K+、Ag+,阴离子有NO3-、OH-(电解质电离的离子有重复)。
图1装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为铂电极。接通电源,经过一段时间后,测得甲中b电极质量增加了43.2 g。常温下各烧杯中溶液pH与电解时间t关系如图2。请回答下列问题:
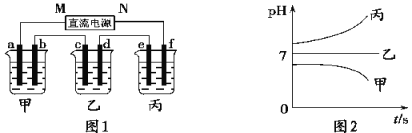
(1)写出三种强电解质的化学式:A____________;B____________;C____________。
(2)写出甲烧杯中总反应的化学方程式___________________________________________。
(3)若甲烧杯中溶液体积为400 mL(忽略溶液体积的变化) ,电解一段时间后甲烧杯溶液的pH=_______,丙烧杯e电极上生成的气体在标准状况下的体积为_______________。
(4)若直流电源使用的是铅蓄电池,铅蓄电池的正极材料是PbO2,负极材料是Pb,电解质溶液是H2SO4溶液,则放电时M极上发生的电极反应为_____________________________________。铅蓄电池充电时,若阳极和阴极之间用阳离子交换膜(只允许H+通过)隔开,则当外电路通过0.2 mol电子时,由阳极室通过阳离子交换膜进入阴极室的阳离子有________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的![]() ,达到新平衡后,体系中含有18O的物质是
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
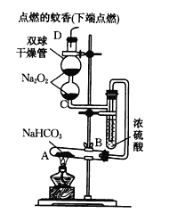
(1)在A试管内发生反应的化学方程式是_____________。
(2)B装置的作用是____________。
(3)在双球干燥管内发生反应的化学方程式为___________________,该反应中氧化剂为________,氧化产物为________,每有1molNa2O2发生反应,转移电子数目为________。
(4)双球干燥管内观察到的实验现象是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com