
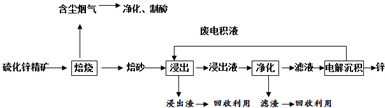

分析 (1)焙烧中硫化锌与氧气在高温下反应生成氧化锌和二氧化硫;
(2)①ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
②锌的活泼性强于铁,能够与二价铁离子反应生成铁;
③依据题意“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质,可知反应物中含有H+和O2,可以获得非金属单质S;
(3)①根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,据此写出方程式;
②铅浮渣中含银,银也和硝酸反应;硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4;
③Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,过滤得滤液含硝酸;铁棒上镀锌,镀层金属作阳极,锌作阳极;
(4)正极得电子发生还原反应,根据总反应书写电极方程式.
解答 解:(1)由题中信息可知,闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,反应的化学方程式为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;
故答案为:2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2;
(2)①ZnS在氧气燃烧发生氧化还原反应生成产物出来氧化锌外还有硫的氧化物,可转换为硫酸,用于后续的浸出操作;
故答案为:浸出;
②该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,离子方程式:Zn+Fe2+=Zn2++Fe;
故答案为:置换出Fe等,以达到净化的目的;
③“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O,
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(3)①根据题给信息硝酸把铅氧化成Pb2+,硝酸被还原成NO,故反应方程式为3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
故答案为:3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O;
②若硝酸过量,则过量的硝酸会和银反应生成硝酸银,产品中会有杂质,所以步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液;硫酸钙微溶,易沉淀在PbSO4表面,所以需用Pb(NO3)2溶液多次洗涤,除去CaSO4,
故答案为:防止Ag被溶解进入溶液(或使Ag留在浸出渣中);除去附着在硫酸铅表面的微溶物硫酸钙;
③Pb(NO3)2溶液加硫酸后生成硫酸铅沉淀和硝酸,所以母液可循环利用于步骤I,其溶质主要是HNO3,铁棒上镀锌,镀层金属作阳极,锌作阳极,
故答案为:HNO3;Zn或锌;
(4)正极得电子发生还原反应,电极方程式为:Ag2O+H2O+2e-═2Ag+2OH-,
故答案为:Ag2O+H2O+2e-═2Ag+2OH-.
点评 本题为工艺流程题,为高考常见题型,侧重学生的分析、实验能力的考查,通过锌的炼制、金属的冶炼原理、电解原理及其应用,考查了化学方程式、离子方程式的书写及计算,物质分离提纯的方法,明确工艺流程及各种物质的性质是解题关键,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | Na[Al(OH)4] | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲为氯化钡 | B. | 乙溶液含有Cl- | ||
| C. | 丙溶液含有 SO42- | D. | 丁溶液含有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com