

| ||
| ||
| 5.40g |
| 108g/mol |
| 0.05mol |
| 4 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、物质甲可能是KMnO4 |
| B、反应中只体现了硝酸的强氧化性 |
| C、氧化过程的反应式一定为Cu2O-2e-+2H+═2Cu2++H2O |
| D、反应中若产生3.0 g气体,则转移电子数约为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:A<B<C |
| B、A的氢化物稳定性大于C的氢化物稳定性 |
| C、高温下,C单质能置换出A单质 |
| D、三种元素的最高价氧化物对应水化物均可由化合反应得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再 | 现象:溶液变成黄色.结论:可能是生成了Fe3+、也可能是生成了I2. |
| 步骤2: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
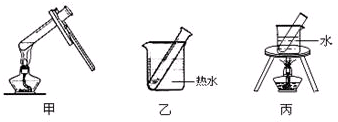
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的PH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
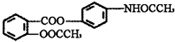 贝诺酯片为对乙酰氨基酚与阿司匹林的脂化物.其结构简式如图,下列有关贝诺酯的叙述中正确的是( )
贝诺酯片为对乙酰氨基酚与阿司匹林的脂化物.其结构简式如图,下列有关贝诺酯的叙述中正确的是( )| A、贝诺酯的分子式为C17H15NO5 |
| B、贝诺脂能发生取代反应,但不能发生还原反应 |
| C、该有机物能够燃烧,可生成CO2、N2和H2O,则1mol该有机物燃烧一定消耗18.5mol O2 |
| D、1mol贝诺酯最多能与8mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com