
【题目】下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是
A. CO2 B. H2O C. CO32﹣ D. CCl4
【答案】B
【解析】
试题价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对个数=σ键个
数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=![]() ×(a-xb),a指中心原子价电子个数,x
×(a-xb),a指中心原子价电子个数,x
指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的
排布,不包括中心原子未成键的孤对电子;A.CO2分子中每个O原子和C原子形成两个共用电子对,
所以C原子价层电子对个数是2,且不含孤电子对,为直线形结构,VSEPR模型与分子立体结构模型
一致,故A不选;B.水分子中价层电子对个数=2+![]() ×(6-2×1)=4,VSEPR模型为正四面体结构;
×(6-2×1)=4,VSEPR模型为正四面体结构;
含有2个孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不
一致,故B选;C.CO32-的中心原子C原子上含有3个σ 键,中心原子上的孤电子对数=![]() (4+2-2×3)
(4+2-2×3)
=0,所以CO32-的空间构型是平面三角形,VSEPR模型与分子立体结构模型一致,故B不选;D.CCl4
分子中中心原子C原子原子价层电子对个数=σ键个数+孤电子对个数=4+![]() (4-1×4)=4,VSEPR模型
(4-1×4)=4,VSEPR模型
为正四面体结构,中心原子不含有孤电子对,分子构型为正四面体结构,VSEPR模型与分子立体结构
模型一致,故D不选。故选B。


科目:高中化学 来源: 题型:
【题目】浓硫酸分别和三种钠盐反应,下列分析正确的是

A. 对比①和②可以说明还原性Br->Cl-
B. ①和③相比可说明氧化性Br2>SO2
C. ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D. ③中浓H2SO4被还原成SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
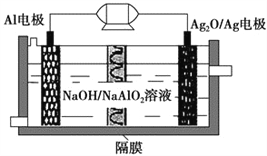
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
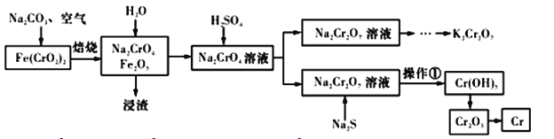
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________________________;焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH应小于3.0,可用_________________测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是①__________________________和②___________________________。
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合下图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水)____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:

资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.5SO32-+2IO3-+2H+=I2+5SO42-+H2O;
Ⅳ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____________。
(2)方案甲中,根据I2的特性,分离操作X的名称是________________。
(3)已知:反应②中每吸收3molI2转移5mol电子,其离子方程式是_______________。
(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是_______________。
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____E (填>、<或=);
(2)B、C单质熔点B_____C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________杂化;其固态晶体类型为_____________;
(4)氢化物的沸点:B比D高的原因______________;
(5)F的核外电子排布式为____________________________;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出深蓝色晶体,该晶体的化学式为_______,其中关于该晶体下列说法中正确的是_____________________。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn-中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn-被________个等距离的C+离子包围。已知该晶体的密度为ρg.cm-3,阿伏加德罗常数为NA,CnX的摩尔质量为M g/mol,C+和Xn-间的最短距离是_____________nm。(列出计算式即可)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是
A. ①② B. ①③ C. ④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示原电池装置,回答下列问题:
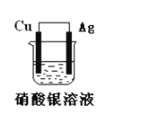
(1)此电池的负极是:______,正极的电极反应式是:________。
(2)该电池工作一段时间后,装置中出现的现象________,将银电极小心取出洗涤并晾干,经称量发现比原来增重了5.4g。则导线中通过的电子的物质的量为 ________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com