

| A. | 1mol贝诺酯分子可与6molH2完全反应 | |
| B. | 可用FeCl3 溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 | |
| D. | 乙酰水杨酸和对乙酰氨基酚均可与NaHCO3 溶液反应 |
分析 A.苯环能和氢气发生加成反应;
B.酚羟基能和氯化铁发生显色反应;
C.贝诺酯与足量NaOH溶液共热发生水解,-COOC-、-NH-CO-均发生断键;
D.羧基能和碳酸氢钠溶液反应.
解答 解:A.苯环能和氢气发生加成反应,1mol贝诺酯分子可与6molH2完全反应,故A正确;
B.酚羟基能和氯化铁发生显色反应,乙酰水杨酸中不含酚羟基、对乙酰氨基酚中含有酚羟基,所以可以用氯化铁溶液鉴别乙酰水杨酸和对乙酰氨基酚,故B正确;
C.贝诺酯与足量NaOH溶液共热发生水解,-COOC-、-NH-CO-均发生断键,不生成乙酰水杨酸钠和对乙酰氨基酚钠,故C错误;
D.乙酰水杨酸含-COOH,酚-OH的酸性不能与NaHCO3溶液反应,则只有乙酰水杨酸能与NaHCO3溶液反应,故D错误;
故选AB.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,注意肽键能发生水解反应,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
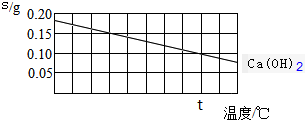
| A. | 氢氧化钙的溶解是吸热过程 | |
| B. | 温度升高时氢氧化钙溶解的速度减慢 | |
| C. | t℃时氢氧化钙的Ksp约等于2.46×10-4 | |
| D. | 向含有Ca(OH)2和Mg(OH)2两种沉淀的悬浊液中滴加NaOH浓溶液,分散系中$\frac{c(C{a}^{2+})}{c(M{g}^{2+})}$的比值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PbO2是电池的负极 | |
| B. | 负极的电极反应式为:Pb(s)+SO42-(aq)-2e -=PbSO4(s) | |
| C. | 铅蓄电池属于一次电池 | |
| D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质不可以与CO2反应 | |
| B. | Y的氧化物是良好的半导体材料 | |
| C. | Z的氢化物比W的氢化物更稳定 | |
| D. | X的最高价氧化物和Z的最高价氧化物化合的产物中有共价键和离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)
乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4),它是一种重要的化工原料.(常温下0.01mol/L的H2C2O4、KHC2O4、K2C2O4溶液的pH如表所示.)| H2C2O4 | KHC2O4 | K2C2O4 | |
| pH | 2.1 | 3.1 | 8.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
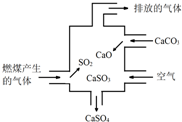
| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内既发生了化合反应,也发生了分解反应 | |
| C. | 总反应可表示为:2SO2+2CaCO3+O2→2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
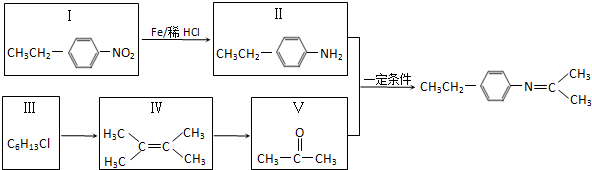
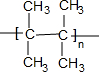 .
.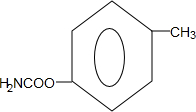 (写出一种).
(写出一种).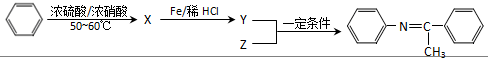
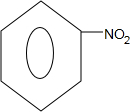 ,Z的结构简式为
,Z的结构简式为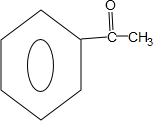 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com