
 ;D
;D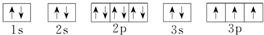 .
.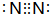 ,氢化物
,氢化物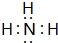 .
. 分析 有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数大于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素,据此解答.
解答 解:有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,则A为氢元素;B元素原子的核外p轨道电子数比s轨道电子数少1,B原子核外电子排布为1s22s22p3,为N元素;C为金属元素且原子核外p轨道电子数和s轨道电子数相等,原子序数大于氮元素,处于第三周期,核外电子排布为1s22s22p63s2,则C为Mg元素,D元素的原子核外所有p轨道全满或半满,原子序数大于Mg,则核外电子排布为1s22s22p63s23p3,则D为P元素.
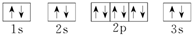
(1)C为Mg元素,基态原子核外电子排布图为 ,D为P元素,基态原子核外电子排布图:
,D为P元素,基态原子核外电子排布图: ,
,
故答案为: ;
; ;
;
(2)B元素单质为N2,电子式为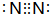 ,其氢化物为NH3,电子式:
,其氢化物为NH3,电子式: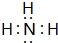 ,
,
故答案为: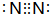 ;
;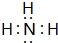 .
.
点评 本题考查结构性质位置关系、核外电子排布规律、常用化学用语,难度不大,掌握核外电子排布规律是推断的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是难溶于水的酸性氧化物 | |
| B. | 高温下SiO2与碳酸盐反应生成CO2 | |
| C. | SiO2不能与任何酸反应 | |
| D. | 碳化硅(SiC)具有金刚石的结构,硬度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
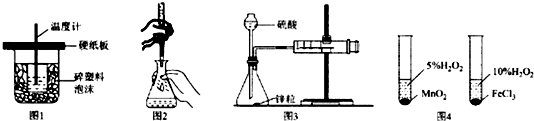
| A. | 图1装置用于中和热的测定 | |
| B. | 图2装置用于高锰酸钾溶液滴定草酸 | |
| C. | 图3装置用于测定氢气的反应速率(单位mL/s) | |
| D. | 图4装置用于研究不同催化剂对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
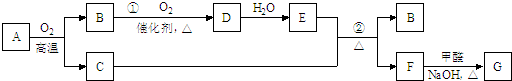
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y的单质均具有较高的熔沸点 | |
| B. | Z、W形成的化合物中既含有离子键,有含有共价键 | |
| C. | 原子半径由大到小的顺序:X、Y、Z | |
| D. | 最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
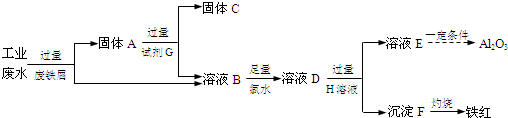
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com