
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |
分析 A.氨气溶于1L水中,所得溶液的体积不是1L;
B.10g质量分数为98%的硫酸溶液中含有9.8g硫酸,物质的量为0.1mol,但是硫酸溶液密度大于1g/mL,溶液的体积不是1L;
C.溶液混合后体积变小;
D.根据胆矾的物质的量及c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:A.将0.1mol氨气充分溶解在1L水中,所得溶液的体积不是1L,溶液的浓度不是0.1mol/L,故A错误;
B.将10g质量分数为98%的硫酸与990g水混合,所得溶液中含有硫酸9.8g,物质的量为0.1mol,溶液质量为1000g,但是硫酸溶液的密度大于1g/mL,溶液的体积小于1L,所以溶液的物质的量浓度大于0.1mol/L,故B错误;
C.溶液混合后体积不是100ml,故C错误;
D.25.0g胆矾的物质的量为0.1mol,0.1mol胆矾溶于水配成1L溶液,所得溶液浓度为0.1mol/L,故D正确;
故选D.
点评 本题考查了物质的量浓度计算、一定浓度的溶液配制,题目难度不大,注意掌握物质的量浓度的根据及计算方法,选项AC为易错点,注意所得溶液的体积不是1L.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
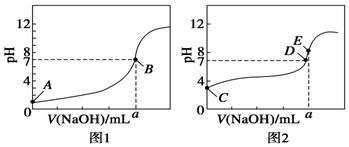 常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.
常温下,用0.100 0mol•L-1 NaOH溶液分别滴定20.00mL 0.100 0mol•L-1 HCl溶液和20.00mL 0.100 0mol•L-1 CH3COOH溶液,得到两条滴定曲线,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
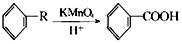 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.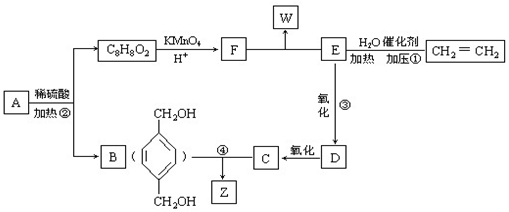
 +2CH3COOH$?_{△}^{浓硫酸}$
+2CH3COOH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O.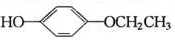 、
、 、
、 、
、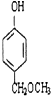 任意2个 (任写两种)
任意2个 (任写两种)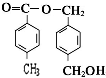 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成白色沉淀、有气泡产生 | B. | 生成红褐色沉淀、有气泡产生 | ||
| C. | 生成黑色沉淀,有气泡产生 | D. | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 常温常压下,92gNO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g质量分数为46%的乙醇水溶液中所含原子数目为0.6NA | |
| B. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| C. | 常温常压下.4.4gN2O与CO2的混合气体中含的原子数目为0.3NA | |
| D. | 常温下,1molC5H12中含有共价键数为16NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com